Ακετόνη
| Ακετόνη | |||
|---|---|---|---|

| |||

| |||

| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Ακετόνη | ||
| Άλλες ονομασίες | Ακετόνη β-κετοπροπάνιο 2-οξοπροπάνιο Διμεθυλοκετόνη Διμεθυλοφορμαλδεΰδη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H6O | ||
| Μοριακή μάζα | 58,08 amu | ||
| Σύντομος συντακτικός τύπος |
CH3COCH3 | ||
| Συντομογραφίες | Me2CO DMK | ||
| Αριθμός CAS | 67-64-1 | ||
| SMILES | O=C(C)C | ||
| InChI | 1/C3H6O/c1-3(2)4/h1-2H3 | ||
| Αριθμός EINECS | 200-662-2 | ||
| Αριθμός RTECS | AL31500000 | ||
| PubChem CID | 180 | ||
| ChemSpider ID | 175 | ||
| Δομή | |||
| Διπολική ροπή | 2,91 D | ||
| Μήκος δεσμού | 152 pm (C-C) 121,3 pm (C=O) 110,3[ pm (C-H) | ||
| Είδος δεσμού | σ (2sp3-2sp2) (C-C) σ ((2sp2-2sp2) (C=O) π (2p-2p) (C=O) (2sp3-1s) (C-H) | ||
| Πόλωση δεσμού | 19% C+ O- (C=O) 3% C- H+ (C-H) | ||
| Γωνία δεσμού | 116° (C-C-C) | ||
| Μοριακή γεωμετρία | τριγωνική επίπεδη στο καρβονύλιο | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 8 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −94,9 °C | ||
| Σημείο βρασμού | 56,53 °C | ||
| Πυκνότητα | 792,5 kg/m3 | ||
| Διαλυτότητα στο νερό |
Αναμίξιμη | ||
| Ιξώδες | 0,3075 cP (20 °C) | ||
| Δείκτης διάθλασης , nD |
1,35900 (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 24,2 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-17 °C | ||
| Σημείο αυτανάφλεξης | 465 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτη (F) Ερεθιστική (Xi) | |||
| Φράσεις κινδύνου | R11, R36, R66, R67 | ||
| Φράσεις ασφαλείας | (S2), S9, S16, S26 | ||
| LD50 | 3 g/kg | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η προπανόνη (συστηματική ονομασία) ή ευρέως πιο γνωστή ως ακετόνη (εμπειρική ονομασία), ή ασετόν ή 2-οξοπροπάνιο ή β-κετοπροπάνιο ή διμεθυλοκετόνη ή διμεθυλοφορμαλδεΰδη (αγγλικά: acetone, propanone) είναι οργανική χημική ένωση, που περιέχει άνθρακα, οξυγόνο και υδρογόνο, με μοριακό τύπο C3H6O, αν και συχνά γράφεται πιο αναλυτικά ως CH3COCH3 ή και (συντομογραφικά) Me2CO ή DMK (DiMethylKetone). Είναι η απλούστερη κετόνη που υπάρχει. Η χημικώς καθαρή προπανόνη, στις συνηθισμένες συνθήκες, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm), είναι ένα άχρωμο και εύφλεκτο υγρό.
Η ακετόνη είναι αναμείξιμη με το νερό και εξυπηρετεί ως ένας σημαντικός (πολικός) διαλύτης και τυπικό καθαριστικό σκευών σε χημικά εργαστήρια. Περίπου 6,9 εκατομμύρια τόννοι προπανόνης παράχθηκαν παγκοσμίως το 2021, κυρίως για χρήση ως διαλύτης και ως πρόδρομη ένωση για την παραγωγή μεθυλομεθακρυλικού οξέος και διφαινόλης Α[1][2]. Είναι επίσης μια συνηθισμένη πρόδρομη ύλη για την ανοικοδόμηση πιο σύνθετων (από αυτήν) οργανικών ενώσεων. Μερικές συνηθισμένες οικιακές χρήσεις της προπανόνης είναι ως ένα ενεργό αφαιρετικό νυχιών, για το καθάρισμα ή και ξεβάψιμο των νυχιών από όζες και βερνίκια, καθώς και ως αφαιρετικό χρωμάτων γενικότερα.
Παράγεται και αποβάλλεται από το ανθρώπινο σώμα, μέσω φυσιολογικών μεταβολικών διεργασιών. Περιέχεται φυσιολογικά, τόσο στο αίμα, όσο και στα ούρα. Οι διαβητικοί παράγουν προπανόνη σε μεγαλύτερες ποσότητες. Αναπαραγωγικά πειράματα τοξικότητας καταδεικνύουν ότι έχει χαμηλό δυναμικό τοξικότητας για να προκαλέσει προβλήματα αναπαραγωγής. Στην πραγματικότητα, το ίδιο ανθρώπινο σώμα αυξάνει φυσικά τη συγκέντρωση προπανόνης σε έγκυες γυναίκες, θηλάζουσες μητέρες και στα παιδιά, επειδή οι σχετικά αυξημένες ενεργειακές τους ανάγκες οδηγούν στη αύξηση των επιπέδων παραγωγής προπανόνης. Η ιατρική κοινότητα, χρησιμοποιεί πλέον κετογενικές δίετες, που αυξάνουν την προπανόνη στο σώμα, για να μειώσουν τα επιληπτικά επεισόδια, σε βρέφη και παιδιά που υποφέρουν από επιληψία.
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το μοριακό της τύπο, C3H6O έχει τα ακόλουθα οκτώ (8) ισομερή:
- 1-προπεν-1-όλη (ελάσσον ταυτομερές της προπανάλης με σύντομο συντακτικό τύπο CH3CH=CHOH (σε δύο (2) γεωμετρικά ισομερή).
- 2-προπεν-1-όλη ή αλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=CHCH2OH.
- 2-προπενόλη (ελάσσον ταυτομερές της προπανόνης] με σύντομο συντακτικό τύπο CH3C(OH)=CH2.
- Βινυλομεθυλαιθέρας ή μεθοξυαιθένιο με σύντομο συντακτικό τύπο CH3OCH=CH2.
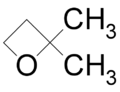
- Κυκλοπροπανόλη με σύντομο συντακτικό τύπο
.
- Προπανάλη (κύριο ταυτομερές) της 1-προπεν-1-όλης με σύντομο συντακτικό τύπο CH3COCH3.
- Οξετάνιο με σύντομο συντακτικό τύπο
.
- Μεθυλοξιράνιο με σύντομο συντακτικό τύπο
.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «προπανόνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-όνη» φανερώνει ότι περιέχει ένα καρβονύλιο (>C=O), που δεν βρίσκεται στην άκρη του μορίου, ως κύρια χαρακτηριστική ομάδα, δηλαδή ότι πρόκειται για κετόνη.
Η ονομασία «2-οξοπροπάνιο» προέρχεται από την «ονοματολογία υποκατάστασης», κατά την οποία η ένωση υποτίθεται ότι είναι προπάνιο, του οποίου δύο άτομα υδρογόνου, του #2 ατόμου άνθρακα, υποκαθίσταται από ένα άτομο οξυγόνου, που συνδέεται με διπλό δεσμό.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp³-1s | 110,3 pm | 3% C- H+ |
| C-O | σ | 2sp³-2sp³ | 152 pm | 19% C+ O- |
| C=O | σ | 2sp²-2sp² | 121,3 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-C | σ | 2sp³-2sp² | 151 pm | |
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (C=O) | -0,38 | |||
| C#1,#3 | -0,09 | |||
| Η (H-C) | +0,03 | |||
| C#2 | +0,38 | |||
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η προπανόνη παράχθηκε για πρώτη φορά από αλχημιστές κατά τα τέλη του Μεσαίωνα, με ξηρή απόσταξη αλάτων του αιθανικού οξέος, όπως για παράδειγμα αιθανικού μολύβδου [(CH3COO)2Pb]. Τότε ονόμαζαν την προπανόνη «πνεύμα του Κρόνου» (spirit of Saturn), γιατί το αλχημικό σύμβολο για το μόλυβδο αποτελούσε επίσης το αστρολογικό σύμβολο του πλανήτη Κρόνου[5]. Το 1832, ο Γάλλος χημικός Ζαν Μπατίστ Ντυμά (Jean Baptiste Dumas) και ο Γερμανός χημικός Γιούστους φον Λίμπιγκ (Justus von Liebig) καθώρησαν τον εμπειρικό τύπο της προπανόνης[6]. Το 1833, ο Γάλλος χημικός Αντουάν Μπουσύ (Antoine Bussy) ονόμασε την (τότε νέα ένωση) «ακετόνη» (acetone), συνδυάζοντας το πρόθεμα «ακετ-» από το αντίστοιχο καρβοξυλικό οξύ (acetic acid) με την κατάλληξη «-όνη»[7]. Το 1852 ο Άγγλος χημικός Αλεξάντερ Γουΐλλιαμ Γουΐλλιαμσον (Alexander William Williamson) συνειδητοποίησε ότι η δομή της προπανόνης είναι μεθυλοακετύλιο[8]. Την επόμενη χρονιά, ο Γάλλος χημικός Σαρλ Φρεντερίκ Ζεράρ (Charles Frédéric Gerhardt) επίσης το επιβεβαίωσε[9]. Το 1865, ο Γερμανός χημικός Άουγκουστ Κεκουλέ (August Kekulé) δημοσίευσε το σύγχρονο συντακτικό τύπο της προπανόνης[10].
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιοσύνθεση
[Επεξεργασία | επεξεργασία κώδικα]Μικρές ποσότητες προπανόνης παράγονται στο (ανθρώπινο, αλλά όχι μόνο) σώμα με αποκαρβοξυλίωση κετοξέων. Αυτή η διεργασία, που ονομάζεται κέτωση, μπορεί να ενισχυθεί με ειδικές δίαιτες, που περιλαμβάνουν συνδυασμό υψηλής λήψης λιπών και χαμηλής λήψης σακχάρων. Στην περίπτωση αυτή η προπανόνη παράγεται από τους ιστούς του σώματος, και στη συνέχεια, υπό ορισμένες συνθήκες υγείας, όπως ο αλκοολισμός και σακχαρώδης διαβήτης, μπορεί να προκαλέσει κετοξείδωση. Ανεξέλεκτη κέτωση μπορεί να οδηγήσει σε μια απότομη, και εν δυνάμει θανατηφόρα, αύξηση της οξύτητας στο αίμα. Εφόσον είναι ένα παραπροϊόν ζύμωσης, η προπανόνη μπορεί να παραχθεί ως παραπροϊόν της βιομηχανίας απόσταξης (αιθανόλης).
Βιομηχανική παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το 2010 η παγκόσμια ετήσια παραγωγική χωρητικότητα για την προπανόνη εκτιμήθηκε σε 6,7 εκατομμύρια τόνους[11], Με 1,56 εκατομμύρια τόννους οι ΗΠΑ έχουν την μεγαλύτερη ετήσια παραγωγή[12], ακολουθούμενες από την Ταϊβάν και την Κίνα. Ενδεικτικά, η τιμή της προπανόνης κυμαίνονταν σε 1100-1250 $ ΗΠΑ/ τόνο το Καλοκαίρι του 2011 στις ΗΠΑ[13].
Κύρια μέθοδος
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική οξείδωση κουμένιου [PhCH(CH3)2] παράγεται φαινόλη (PhOH) και προπανόνη[14]:
Άλλες χρησιμοποιούμενες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με πυρόλυση αιθανικού ασβεστίου
[Επεξεργασία | επεξεργασία κώδικα]Με πυρόλυση αιθανικού ασβεστίου [(CH3COO)2Ca] παράγεται προπανόνη[15]:
Άλλες διαθέσιμες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική οξείδωση προπενίου
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική οξείδωση προπενίου, με τη μέθοδο Wacker-Ηoechst, παράγεται προπανόνη[16]:
- όπου DMF διμεθυλομεθαναμίδιο.
Με καταλυτική οξείδωση προπανίου
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική οξείδωση προπανίου (C3H8) παράγεται (κυρίως) προπανόνη:
Με οργανομαγνησιακές ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση μεθυλομαγνησιοαλογονίδιου (CH3MgX) σε αιθανικό αλκυλεστέρα (CH3COOR) παράγεται προπανόνη[17]:
2. Με επίδραση μεθυλομαγνησιοαλογονίδιου (CH3MgX) σε αιθανονιτρίλιο παράγεται προπανόνη[18]:
Με οξείδωση 2-προπανόλης
[Επεξεργασία | επεξεργασία κώδικα]Με οξείδωση 2-προπανόλης [CH3CH(OH)CH3] παράγεται προπανόνη[19]:
Με προσθήκη ύδατος σε προπίνιο
[Επεξεργασία | επεξεργασία κώδικα]Με ενυδάτωση προπινίου (CH3C ≡ CH) παράγεται αρχικά η ταυτομερής 2-προπενόλη, που ταυτομερίζεται σε προπανόνη[20]:
Με οζονόλυση 2,3-διμεθυλο-2-βουτένιου
[Επεξεργασία | επεξεργασία κώδικα]Με οζονόλυση 2,3-διμεθυλο-2-βουτένιου παράγεται προπανόνη[21]:
Με επίδραση υπερμαγγανικού καλίου σε 2,3-διμεθυλο-2-βουτένιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υπερμαγγανικού καλίου σε 2,3-διμεθυλο-2-βουτένιο παράγεται προπανόνη[22]:
- Υπερβολικά έντονες οξειδωτικές συνθήκες μπορούν να οδηγήσουν σε παραπέρα οξείδωση, με διάσπαση της προπανόνης, σχηματίζοντας μεθανικό οξύ και αιθανικό οξύ. Δείτε παρακάτω στην ενότητα «Χημικές ιδιότητες και παράγωγα».
Με επίδραση υπεριωδικού οξέος σε 2,3-διμεθυλο-2,3-βουτανοδιόλη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υπεριωδικού οξέος σε 2,3-διμεθυλο-2,3-βουτανοδιόλη παράγεται προπανόνη[23]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Ταυτομέρεια με 2-προπενόλη
[Επεξεργασία | επεξεργασία κώδικα]Η προπανόνη βρίσκεται πάντα σε χημική ισορροπία με την ταυτομερή της 2-προπενόλη. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων ή βάσεων[24]:
Αναγωγή προς 2-προπανόλη
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς 2-προπανόλη με τις ακόλουθες μεθόδους[25]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς προπάνιο
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς προπάνιο με την αντίδραση Clemensen[26]
Οξείδωση προς 2-οξοπροπανάλη
[Επεξεργασία | επεξεργασία κώδικα]1. Μπορεί να οξειδωθεί προς 2-οξοπροπανάλη με χρήση διοξειδίου του σεληνίου[27]
2. Μπορεί να οξειδωθεί προς 2-οξοπροπανάλη μέσω νιτρώδωσης, δηλαδή επίδρασης νιτρώδους οξέος[28]
Προσθήκη ύδατος
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη ύδατος σε προπανόνη παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής 2,2-προπανοδιόλη[29]:
Προσθήκη 1,2-αιθανοδιόλης
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη 1,2-αιθανοδιόλης παράγεται 2,2-διμεθυλο-1,3-διοξολάνιο[30]:
Προσθήκη 1,2-αιθανοδιθειόλης
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 2,2-διμεθυλο-1,3-διθειολάνιο[30]:
- Το 2,2-διμεθυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας προπάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[31]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 2-προπανιμίνη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλο-2-προπανιμίνη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται 2-προπανοξίμη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά ισοπροπυλιδενυδραζίνη και με περίσσεια προπανάλης διισοπροπυλιδενυδραζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-ισοπροπυλιδενο-2-φαινυλυδραζίνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-προπυλιδενυδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)-2-προπανόλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλο-2-προπεναμίνη[32]:
Αλδολική συμπύκνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 4-μεθυλο-4-υδροξυ-2-πεντανόνη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 4-μεθυλο-2-πεντεν-3-όνη[33]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
[Επεξεργασία | επεξεργασία κώδικα]Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[34]:
Συμπύκνωση με α-αλεστέρες
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση α-αλεστέρων (R'CHXCOOR) έχουμε την αντίδραση Darzen, κατά την οποία τελικά παράγεται 1-καρβαλκοξυ-2,2-διμεθυλοξιράνιο. Π.χ. με αλαιθανικό αλκυλεστέρα (XCH2COOR) έχουμε[35]:
Επίδραση φωσφοροϋλιδίων
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 1,1-διαλκυλο-2-μεθυλ-1-οπροπένιο[36]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
[Επεξεργασία | επεξεργασία κώδικα]Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στο διπλό δεσμό C=Ο που περιέχει η προπανόνη. Π.χ.:[37]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά μεθυλοϋδροξυπροπανονιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί μεθυλοϋδροξυπροπανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται 2-υδροξυ-2-προπανοσουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 2-αλκυλο-2-προπανόλη:
4. Με προσθήκη πενταχλωριούχου φωσφόρου παράγεται 2,2-διχλωροπροπάνιο:
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στην 2-προπενόλη. Παράγεται αρχικά η ασταθής 1,2-διαλο-2-προπανόλη, που αφυδραλογονώνεται σχηματίζοντας τελικά αλοπροπανόνη[38]:
Επίδραση διαζωμεθανίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση διαζωμεθάνιου παράγεται 2,2-διμεθυλοξιράνιο[39]:
Επίδραση υδραζωτικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται N-μεθυλαιθαναμίδιο[40]:
Αντίδραση Stracker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε προπανάλη παράγεται αρχικά 2-αμινο-2-μεθυλοπροπανονιτρίλιο και στη συνέχεια, με υδρόλυση, 2-αμινο-2-μεθυλοπροπανικό οξύ (ένα μη πρωτεϊνικό αμινοξύ)[41]:
Φωτοχημική προσθήκη σε αλκένια
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση προπανόνης σε αιθένιο σχηματίζεται φωτοχημικά 2,2-διμεθυλοξετάνιο (αντίδραση Paterno–Büchi)[42] [43]:
Επίδραση ισχυρών οξειδωτικών συνθηκών
[Επεξεργασία | επεξεργασία κώδικα]Με ισχυρά οξειδωτικά μέσα και δραστικές συνθήκες, είναι δυνατή η οξείδωση της προπανόνης προς διοξείδιο του άνθρακα και αιθανικό οξύ[44]:
- Ενδιάμεσα σχηματίζεται και μεθανικό οξύ, το οποίο όμως είναι ευαίσθητο στην τυχόν περίσσεια υπερμσγγανικού καλίου:
Αλοφορμική αντίδραση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αλογόνου (X2) σε αλκαλικό περιβάλλον σε προπανόνη, έχουμε τη λεγόμενη αλοφορμική αντίδραση, και παράγονται αλοφόρμιο και αιθανικό άλας[45]:
Οξείδωση Baeyer - Villiger
[Επεξεργασία | επεξεργασία κώδικα]Με οξείδωση Baeyer - Villiger από καρβονικό υπεροξύ (RCO3H) παράγονται αιθανικός μεθυλεστέρας και καρβονικό οξύ[46]:
Παραγωγή διόλης
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νατρίου ή μαγνησίου σε προπανόνη παράγεται τελικά 2,3-διμεθυλο-2,3-βουτανοδιόλη[47]:
Προσθήκη ορθοφορμικών εστέρων
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη ορθοφορμικού εστέρα [(RO)3CH, όπου τα αλκύλια R, όχι απαραίτητα ίδια] έχουμε το σχηματισμό 2,2-διαλκοξυπροπάνιου[48]:
Συμπύκνωση με εστέρες
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση καρβονικών εστέρων (RCOOR, όπου τα αλκύλια R, όχι απαραίτητα ίδια) σε προπανόνη, παρουσία αιθανολικού νατρίου ή νατραμιδίου παράγονται αλκοξυπροπανόνη και αλκοόλη[49]:
Επίδραση καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται βουτανόνη και 2,2-διμεθυλοξιράνιο[50]:
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Σχεδόν στο ένα τρίτο του πλανήτη η προπανόνη χρησιμοποιείται ως ένας διαλύτης και στο ένα τέταρτο αυτού καταναλώνεται, μέσω της κυανυδρίνης της, ως πρόδρομος για το μεθυλακρυλικό οξύ (και τα πολυμερή του)[1].
Ως διαλύτης
[Επεξεργασία | επεξεργασία κώδικα]Η προπανόνη είναι ένας καλός διαλύτης για τα περισσότερα πλαστικά και τις συνθετικές υφάνσιμες ύλες, περιλαμβάνοντας αυτά που χρησιμοποιούνται σε εργαστήρια για φιάλες πολυστυρένιου, πολυκαβονικών ή και κάποιους τύπους πολυπροπυλένιου[51]. Είναι ιδανικό για αραίωση ρητινών υαλοβάμβακα, καθαρισμό εργαλείων χειρισμού υαλοβάμβακα και για να διαλύει εποξείδια και υπερκόλλες πριν σκληρύνουν. Χρησιμοποιήθηκε ως πτητικός διαλύτης για κάποιες μπογιές και βερνίκια. Επίσης, χρησιμοποιήθηκε ως ισχυρός απογρασσωτής. Είναι χρήσιμη για την προετοιμασία μετάλλων πριν από το βάψιμο. Επίσης, αραιώνει πολυεστερικές ρητίνες, πολυβινυλίου και διάφορες κόλλες. Είναι επίσης χρήσιμη για πολύ αξιόπιστες εφαρμογές συγκόλλησης αλλά και αφαίρεσης της περίσσειας ρητινών συγκόλλησης, όταν η συγκόλληση έχει τελειώσει. Χρησιμεύει για να αποφευχθούν αρνητικά φαινόμενα από την παραμονή βρώμικης κόλλας σε επαφή με τα υλικά που συγκολλήθηκαν.
Ακόμη, η προπανόνη χρησιμοποιήθηκε ως ένας διαλύτης για τη φαρμακευτική βιομηχανία και ως ένα μετουσιωτικό σε καθαρή αιθανόλη[52]. Η προπανόνη χρησιμοποιείται ακόμη ως ένα έκδοχο σε ορισμένα φάρμακα[53].
Παρόλο που η προπανόνη είναι η ίδια εύφλεκτη, χρησιμοποιήθηκε ως ένας διαλύτης για την ασφαλέστερη μεταφορά και αποθήκευση αιθίνιου, γιατί το τελευταίο δεν μπορεί να συμπιεστεί με ασφάλεια αν βρίσκεται σε καθαρή μορφή. Δοχεία που κατασκευάζονται από ένα πορώδες υλικό πρώτα γεμίζονται με προπανόνη, μέσα στην οποία διαλύεται στη συνέχεια το αιθίνιο. Σημειώνεται ότι ένα λίτρο προπανόνης διαλύει περίπου 250 λίτρα αιθινίου[54][55].
Ως χημικό ενδιάμεσο
[Επεξεργασία | επεξεργασία κώδικα]Η προπανόνη χρησιμοποιήθηκε στην παραγωγή του μεθυλακρυλικού οξέος ή και των εστέρων και των πολυμερών αυτού. Η διαδικασία της παραγωγής αυτής αρχίζει με τη μετατροπή της προπανόνης στην κυανυδρίνη της, δηλαδή σε 2-μεθυλο-2-υδροξυπροπανονιτρίλιο:
Το επόμενο στάδιο περιλαμβάνει την αλκοόλυση του 2-μεθυλο-2-υδροξυπροπανονιτρίλιου με μεθανόλη, οπότε παράγεται μεθυλοπροπενικός μεθυλεστέρας:
- Στην παραπάνω αντίδραση, αν χρησιμοποιηθεί νερό αντί μεθανόλης, δηλαδή με υδρόλυση αντί αλκοόλυσης, παράγεται μεθανοπροπενικό οξύ, ενώ αν χρησιμοποιηθεί άλλη αλκοόλη, παράγεται ο αντίστοιχος εστέρας.
Μια άλλη μεγάλη χρήση της προπανόνης, που απορροφά περίπου το 20% της παραγωγής της[1], είναι η παραγωγή διφαινόλης Α. Η διφαινόλη Α είναι, με τη σειρά της, συνθετικό πολλών πολυμερών, όπως τα «πολυκαρβονικά», οι πολυουρεθάνες και οι εποξυρητίνες. Η παραγωγή διφαινόλης Α από προπανόνη περιλαμβάνει την αντίδραση συμπύκνωσης της προπανόνης με φαινόλη:
Ακόμη, πολλές χιλιάδες τόννοι προπανόνης καταναλώνονται στην παραγωγή 4-μεθυλο-2-πεντανόλης και 4-μεθυλο-2-πεντανόνης. Η παραγωγή αυτών των ενώσεων από προπανόνη γίνεται με χρήση αλδολικής συμπύκνωσης, κατά την οποία η προπανόνη δίνει 4-μεθυλο-4-υδροξυ-2-πεντανόνη[2]:
Εργαστηριακές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Στα χημικό εργαστήρια, η προπανόνη χρησιμοποιήθηκε ως ένας πολικός απρωτικός διαλύτης σε μια ποικιλία οργανικών αντιδράσεων, όπως οι αντιδράσεις τύπου SN2. Η χρήση της προπανόνης είναι κρίσιμη για την οξείδωση Jones. Δεν δημιουργεί κανένα αζεοτροπικό μίγμα με το νερό[56].
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 Acetone, World Petrochemicals report, January 2010
- ↑ 2,0 2,1 Stylianos Sifniades, Alan B. Levy, “Acetone” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Mel Gorman and Charles Doering (1959) "History of the structure of acetone," Chymia, 5 : 202-208.
- ↑ See: J. Dumas (1832) "Sur l'esprit pyro-acétique" (On pyro-acetic spirit), Annales de Chimie et de Physique, 2nd series, 49 : 208-210. Justus Liebig (1832) "Sur les combinaisons produites par l'action du gas oléfiant et l'esprit acétique" (On compounds produced by the action of ethylene and acetic spirit), Annales de Chimie et de Physique, 2nd series, 49 : 146-204 ; see especially pp. 193-204.
- ↑ Antoine Bussy (1833) "De quelques Produits nouveaux obtenus par l’action des Alcalis sur les Corps gras à une haute température" (On some new products obtained by the action of alkalies on fatty substances at a high temperature), Annales de Chimie et de Physique, 2nd series, 53 : 398–412 ; see footnote on p. 409, continued from p. 408.
- ↑ A. W. Williamson (1852) "On Etherification," Journal of the Chemical Society, 4 : 229-239 ; see especially pp. 237-239.
- ↑ Charles Gerhardt (1853) "Researches sur les acids organiques anhydres" (Research on anhydrous organic acids), Annales de Chimie et de Physique, 3rd series, 37 : 285- 342 ; see p. 339.
- ↑ See:Auguste Kekulé (1865) "Sur la constitution des substances aromatiques," Bulletin de la Société chimique de Paris, 1 : 98-110 ; see especially p. 110. Auguste Kekulé (1866) "Untersuchungen über aromatischen Verbindungen" (Investigations into aromatic compounds), Annalen der Chemie und Pharmacie, 137 : 129-196 ; see especially pp. 143-144. Note: Johann Josef Loschmidt had presented the structure of acetone in 1861, but his privately published booklet received little attention. See: J. Loschmidt, Chemische Studien (Vienna, Austria-Hungary: Carl Gerold's Sohn, 1861).
- ↑ Camara Greiner, EO and Funada, C (June 2010). "CEH Marketing Research Report: ACETONE". Chemical Economics Handbook. SRI consulting. Retrieved March 2011.
- ↑ "Acetone Uses and Market Data". ICIS.com. October 2010. Retrieved 2011-03-21.
- ↑ Acetone (US Gulf) Price Report – Chemical pricing information. ICIS Pricing. Retrieved on 2012-11-26.
- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Phenol" in Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH. .
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.4α.
- ↑ Jiro Tsuji, Hideo Nagashima, and Hisao Nemoto (1990), «General Synthetic Method for the preparation of Methyl Ketones from Terminal Olefins: 2-Decanone», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv7p0137; Coll. Vol. 7: 137
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.3.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.152, §6.2.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.222, §9.7.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 30,0 30,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.14.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.4.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.6.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 223, §9.7.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ NALGENE Labware – Technical Data. Nalgenelabware.com. Retrieved on 2012-11-26.
- ↑ Weiner, Myra L.· Kotkoskie, Lois A. (1999). Excipient Toxicity and Safety. σελ. 32. ISBN 9780824782108.
- ↑ Inactive Ingredient Search for Approved Drug Products, FDA/Center for Drug Evaluation and Research
- ↑ Mine Safety and Health Administration (MSHA) – Safety Hazard Information – Special Hazards of Acetylene Αρχειοθετήθηκε 2016-01-22 στο Wayback Machine.. Msha.gov. Retrieved on 2012-11-26.
- ↑ History – Acetylene dissolved in acetone Αρχειοθετήθηκε 2015-09-15 στο Wayback Machine.. Aga.com. Retrieved on 2012-11-26.
- ↑ What is an Azeotrope?. Solvent—recycling.com. Retrieved on 2012-11-26.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.