Alumine
| Alumine | |
| |
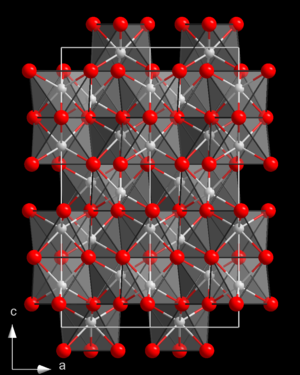
| __ Al3+ __ O2− Structure cristalline de l'alumine α (corindon). |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.014.265 |
| No CE | 215-691-6 |
| No RTECS | BD1200000 |
| DrugBank | DB11342 |
| PubChem | 9989226 |
| ChEBI | 30187 |
| SMILES | |
| InChI | |
| Apparence | solide blanc cristallisé insoluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | Al2O3 [Isomères] |
| Masse molaire[2] | 101,961 3 ± 0,000 9 g/mol Al 52,93 %, O 47,07 %, |
| Propriétés physiques | |
| T° fusion | 2 050 °C[1] |
| T° ébullition | 2 980 °C[1] |
| Solubilité | lentement soluble dans les solutions aqueuses alcalines ; pratiquement insoluble dans les solvants organiques non polaires, l'éther diéthylique, l'éthanol (95 %), l'eau[3] |
| Masse volumique | 3,97 g cm−3[1] à 20 °C |
| Pression de vapeur saturante | 133,3 Pa à 2 158 °C[3] |
| Conductivité thermique | 36,0 W m−1 K−1 à 26 °C 10,9 W m−1 K−1 à 500 °C 6,2 W m−1 K−1 à 1 000 °C[4] |
| Thermochimie | |
| S0liquide, 1 bar | 67,24 J K−1 mol−1[5] |
| S0solide | 50,92 ± 0,10 J K−1 mol−1[5] |
| ΔfH0liquide | −1 620,57 kJ mol−1[5] |
| ΔfH0solide | −1 675,7 ± 1,3 kJ mol−1[5] |
| Cp | 795,5 J K−1 kg−1[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'alumine, ou oxyde d'aluminium, est un composé chimique de formule Al2O3. Il s'agit d'un solide blanc inodore insoluble dans l'eau. Il en existe plusieurs polymorphes, le principal étant l'alumine α, trigonale-rhomboédrique, qui existe dans le milieu naturel sous la forme du minéral appelé corindon, dont certaines variétés sont des pierres précieuses : le rubis, avec des traces de chrome, et le saphir, avec des traces de fer et de titane.
En pétrologie on a l'habitude d'appeler aussi alumine le composant Al2O3 de la composition chimique d'une roche, exprimée en pourcentages d'oxydes, même si les minéraux porteurs d'aluminium n'ont pas cette formule chimique. On dit par exemple de la bauxite, le principal minerai d'aluminium, qu'elle est riche en alumine.
L'alumine est principalement utilisée comme source d'aluminium, comme abrasif en raison de sa dureté de 9,0 sur l'échelle de Mohs (comparable à celle du carbure de tungstène), et comme matériau réfractaire en raison de son point de fusion élevé (atteignant 2 050 °C).
Structure et propriétés
[modifier | modifier le code]L'alumine α, trigonale-rhomboédrique, est le principal polymorphe d'oxyde d'aluminium, constituant le corindon. L'alumine β est en fait le composé Na2O·11Al2O3, soit NaAl11O17[6],[7]. L'alumine γ et η, cubiques, l'alumine θ, monoclinique, l'alumine κ, orthorhombique, l'alumine χ hexagonale, et l'alumine δ, tétragonale ou orthorhombique, sont les autres polymorphes notables de l'oxyde d'aluminium[8]. L'alumine γ, par exemple, est utilisée pour la production de céramiques techniques.
L'alumine est amphotère, c'est-à-dire qu'elle réagit comme un acide en présence d'une base et comme une base en présence d'un acide. Elle forme des aluminates avec de nombreux oxydes métalliques. L'alumine γ, cubique, se présente comme une poudre blanche hygroscopique insoluble dans l'eau mais lentement soluble dans les bases fortes et les acides forts. Elle forme par frittage des solides à la surface poreuse dont la qualité dépend étroitement du procédé et de la température de fabrication. Elle est utilisée comme phase stationnaire en chromatographie. L'alumine γ se transforme dès 800 °C en alumine α, qui est insoluble dans les acides et dans les bases.
L'alumine est un très bon isolant électrique, avec une rigidité diélectrique de 35 kV mm−1 et une résistivité de 1012 Ω m à 20 °C (tombant à 107 Ω m à 1 000 °C) mais présente à température ambiante une conductivité thermique de 35,6 à 39 W m−1 K−1, relativement élevée pour une céramique. Elle se forme facilement à la surface de l'aluminium métallique au contact de l'oxygène de l'air, et constitue une couche mince de passivation, épaisse d'environ 4 nm, qui protège l'intérieur du volume d'aluminium contre la progression de l'oxydation[9]. Un certain nombre d'alliages, comme le cuproaluminium (cuivre avec une fraction d'aluminium), utilisent cette propriété pour renforcer leur résistance à la corrosion.
L'épaisseur et les propriétés de cette couche d'oxyde peuvent être améliorées par traitement de surface de type anodisation. La couche ainsi formée est généralement amorphe mais peut être partiellement cristallisée à l'aide de techniques d'oxydation plasma ou à arc électrique. Ces couches d'alumine peuvent ensuite être renforcées par combinaison avec de l'eau pour former un hydrate d'alumine qui est translucide. Il est possible d'adjoindre des colorants dans la couche superficielle lors de cette opérations pour obtenir des teintes esthétiques.
Production
[modifier | modifier le code]L'alumine a été isolée en 1754 par le chimiste allemand Andreas Sigismund Marggraf à partir de l'alun. C'est Louis Guyton de Morveau (1737-1816), collaborateur d'Antoine Lavoisier, qui baptisa alumine l'un des sulfates contenus dans l'alun.
L'extraction de l'alumine de la bauxite est réalisée suivant un procédé chimique appelé procédé Bayer, inventé par l'Autrichien Karl Josef Bayer. L'alumine est présente dans la bauxite sous forme d'oxydes d'aluminium hydratés — gibbsite Al(OH)3, boehmite γ-AlO(OH) et diaspore α-AlO(OH) — mêlés à des oxydes de fer — goethite FeO(OH) et hématite Fe2O3 — ainsi qu'à du quartz SiO2 et de l'argile. Dans ce procédé, la bauxite est attaquée à la soude NaOH à haute température et sous pression :
Hormis le quartz SiO2, les constituants de la bauxite ne se dissolvent pas dans les bases. La filtration du mélange basique permet d'éliminer l'hématite Fe2O3, puis le mélange est refroidi pour former un précipité d'hydroxyde d'aluminium Al(OH)3 qui laisse les silicates en solution :
- NaAl(OH)4 ⟶ NaOH + Al(OH)3 ↓.
L'hydroxyde est alors calciné au-delà de 1 100 °C pour former de l'oxyde d'aluminium :
- 2 Al(OH)3 ⟶ Al2O3 + 3 H2O.
L'oxyde d'aluminium produit tend à être multiphase, c'est-à-dire qu'il ne contient pas que du corindon, mais également d'autres polymorphes. La composition de l'alumine ainsi produire peut être ajustée en fonction des conditions opératoires ; elle détermine notamment la porosité des surfaces et la solubilité du matériau, ce qui a des impacts sur son coût, son prix de vente et le contrôle de la pollution résultante.
La première usine à exploiter ce procédé est l'usine de Gardanne (anciennement Pechiney) en 1894. Cette usine produit toujours à ce jour des alumines hydratées et calcinées suivant ce procédé. L'alumine d'une grande variété de sources peut être extraite par le biais du procédé Orbite, beaucoup moins polluant, mais encore non utilisé à l'échelle industrielle.
L'alumine est exploitée industriellement pour obtenir de l'aluminium par le procédé électrolytique Héroult-Hall. Elle est aussi utilisée comme matériau réfractaire (résistant aux très fortes températures) et comme céramique, et peut être également utilisée sous forme de corindon pour fabriquer des abrasifs. On fabrique des tuyaux de poêle en alumine pour le chauffage à bois et à fioul.
Applications
[modifier | modifier le code]L'alumine est utilisée dans des applications très diverses. Environ 90 % de la quantité globale est utilisée pour produire de l'aluminium, généralement par électrolyse (procédé Hall-Héroult), le reste étant essentiellement utilisé dans des applications tirant profit de sa résistance chimique, thermique et électrique[10]. Elle est par exemple utilisée comme matériau réfractaire, comme céramique, comme abrasif ou encore dans des applications de polissage. Un volume important est utilisé dans la production de zéolithes, de pigments dans les revêtements en dioxyde de titane et d'agents retardants ou antifumée.
Comme abrasif, l'alumine sert par exemple de substitut bien meilleur marché aux diamants industriels, qu'ils soient naturels ou synthétiques. De nombreux types de papier de verre utilisent des cristaux d'alumine. Le fait qu'elle garde peu la chaleur et ait une capacité thermique peu élevée en font un matériau largement utilisé pour les applications d'usinage par abrasion ou de rectification.
Comme isolant électrique, l'alumine est utilisée dans certains condensateurs[11], ainsi que comme substrat dans certaines technologies silicium sur isolant (SOI), dites dans ce cas Silicon-on-Sapphire (SOS), pour réaliser des circuits intégrés mais aussi des composants supraconducteurs à effet tunnel comme des SET et des SQUID. Il est possible de faire croître des couches minces d'oxyde d'aluminium sur un circuit intégré par échange chimique entre le triméthylaluminium Al2(CH3)6 et l'eau[12] H2O :
Il est également possible d'utiliser de l'ozone O3 à la place de l'eau[13],[14] :
Les couches minces d'oxyde d'aluminium préparées à partir d'ozone présentent un courant de fuite de dix à cent fois plus faible que celles préparées à partir de vapeur d'eau.
L'alumine est employée comme catalyseur dans plusieurs réactions d'importance industrielle, par exemple dans le procédé Claus de récupération du soufre élémentaire à partir des rejets gazeux provenant du raffinage du pétrole, ou encore dans la réaction de déshydratation des alcools en alcènes. C'est en outre un support pour de nombreux catalyseurs industriels, par exemple ceux utilisés en hydrodésulfuration, ou encore en polymérisations Ziegler-Natta.
On l'utilise aussi dans les plaques en céramique de certains gilets pare-balles, souvent comme matrice renforcée de fibres en aramides ou en polyéthylène de masse molaire très élevée (UHMPE), mais elle est moins dure que le carbure de silicium et le carbure de bore, et les plaques en alumine ne sont pas certifiées pour une utilisation militaire.
De l'alumine transparente est par ailleurs utilisée dans certaines lampes à vapeur de sodium.
Commerce
[modifier | modifier le code]En 2014, d'après les douanes françaises, la France est nette importatrice d'alumine. Le prix moyen à l'import était de 310 €/t[15].
Notes et références
[modifier | modifier le code]- Entrée « Aluminium oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 février 2019 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Raymond C. Rowe, Paul J. Sheskey et Marian E. Quinn, Handbook of Pharmaceutical Excipients, Londres, Pharmaceutical Press and American Pharmacists Association, , 6e éd., 888 p. (ISBN 978-0-85369-792-3), p. 377.
- « Aluminium Oxide » dans la base de données Hazardous Substances Data Bank (consulté le 4 juin 2010).
- (en) « Aluminum oxide », sur NIST/WebBook (consulté le 4 juin 2010).
- (en) E. Wiberg et A. F. Holleman, Inorganic Chemistry, Elsevier, 2001 (ISBN 978-0-12-352651-9).
- (en) « Diaoyudaoite Mineral Data », sur webmineral.com (consulté le ).
- (en) Igor Levin et David Brandon, « Metastable Alumina Polymorphs: Crystal Structures and Transition Sequences », Journal of the American Ceramic Society, vol. 81, no 8, , p. 1995-2012 (DOI 10.1111/j.1151-2916.1998.tb02581.x, lire en ligne).
- (en) Timothy Campbell, Rajiv K. Kalia, Aiichiro Nakano, Priya Vashishta, Shuji Ogata et Stephen Rodgers, « Dynamics of Oxidation of Aluminum Nanoclusters using Variable Charge Molecular-Dynamics Simulations on Parallel Computers », Physical Review Letters, vol. 82, no 24, , p. 4866-4869 (DOI 10.1103/PhysRevLett.82.4866, Bibcode 1999PhRvL..82.4866C, lire en ligne).
- (en) K. A. Evans, « Properties and uses of aluminium oxides and aluminium hydroxides », A. J. Downs, The Chemistry of Aluminium, Indium and Gallium, Blackie Academic, 1993 (ISBN 978-0751401035).
- (en) A. Belkin, A. Bezryadin, L. Hendren et A. Hubler, « Recovery of Alumina Nanocapacitors after High Voltage Breakdown », Scientific Reports, vol. 7, , article no 932 (PMID 28428625, PMCID 5430567, DOI 10.1038/s41598-017-01007-9, Bibcode 2017NatSR...7..932B, lire en ligne).
- (en) G. S. Higashi et C. G. Fleming, « Sequential surface chemical reaction limited growth of high quality Al2O3 dielectrics », Applied Physics Letters, vol. 55, no 19, , p. 1963-1965 (DOI 10.1063/1.102337, Bibcode 1989ApPhL..55.1963H, lire en ligne).
- (en) J. B. Kim, D. R. Kwon, K. Chakrabarti et Chongmu Lee, « Improvement in Al2O3 dielectric behavior by using ozone as an oxidant for the atomic layer deposition technique », Journal of Applied Physics, vol. 92, no 11, , p. 6739-6742 (DOI 10.1063/1.1515951, Bibcode 2002JAP....92.6739K, lire en ligne).
- (en) Jaebum Kim, Kuntal Chakrabarti, Jinho Lee, Ki-Young Oh et Chongmu Lee, « Effects of ozone as an oxygen source on the properties of the Al2O3 thin films prepared by atomic layer deposition », Materials Chemistry and Physics, vol. 78, no 3, , p. 733-738 (DOI 10.1016/S0254-0584(02)00375-9, lire en ligne).
- « Indicateur des échanges import/export »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Direction générale des douanes. Indiquer NC8=28182000 (consulté le ).
Sources
[modifier | modifier le code]- International Aluminium Institute (Les valeurs incluent l'alumine destinée à la production d'aluminium — la proportion la plus importante — ainsi que l'alumine destinée à d'autres utilisations.
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Handbook of Porous Solids, vol. 3, Wiley-VCH, 2002