Uranio
| Artikulu edo pasarte honek eduki, gramatika, hiztegi edota ortografia akatsak ditu. Lagundu nahi baduzu, zuzendu ezazu. |
| Uranioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 92 Protaktinioa ← Uranioa → Neptunioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Uranioa, U, 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | aktinidoak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | -, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 238,02891(3) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurazio elektronikoa | [Rn] 5f3 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 8, 32, 21, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solidoa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) 19,1 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-puntua | 1.405,3 K (1.132,2 °C, 2.070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-puntua | 4.404 K (4.131 °C, 7.468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | 9,14 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-entalpia | 417,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bero espezifikoa | (25 °C) 27,665 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | ortoerronbikoa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 3+, 4+, 5+, 6+[1] (oxido basiko ahula) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 1,38 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 597,6 kJ/mol 2.a: 1.420 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsen erradioa | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datu gehiago | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eroankortasun termikoa | (300 K) 27,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soinuaren abiadura | 3.155 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Uranioaren isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Uranioa elementu kimiko bat da, U ikur kimikoa eta 92 zenbaki atomikoa dituena. Egoera estandarrean metal grisa da, dentsitate oso altukoa, xaflakorra eta harikorra. Kimikoki aktinidoen artean sailkatzen da, taula periodikoko 7. periodoko barne-trantsizio metaletakoa baita. Uranio atomo batek 92 protoi eta 92 elektroi ditu, azken hauetatik 6 balentzia elektroiak direlarik. Uranioak desintegrazioa erradioaktiboa jasaten du alfa partikulak igorriz. Desintegrazio hauen erdi-bizitzak isotopoaren araberakoak dira, 159 200 urtetik hasi eta 4,5 mila milioi urtetara, erabilgarriak eginez Lurraren adina kalkulatzeko. Naturan isotoporik egonkorrenak bi dira: uranio-238a (146 neutroi dituena eta uranioaren % 99a osatzen duena) eta uranio-235a (143 neutroi dituena). Elementu primordialen artean uranioa da masa atomiko handiena duena. Naturan milioiko parte batzuen kontzentrazioan aurkitzen da arroketan, lurrean eta uretan. Uranioa erauzteko elementu honetan aberatsak diren mineralak baliatzen dira, uraninita esaterako.
Gaur egun uranioaren erabilera gehienbat bere propietate nuklearrak erabiltzean datza. Uranio-235a fisio nuklearra jasan dezakeen isotopo natural soila da, eta ondorioz erabilgarria zentral nuklear eta arma nuklearrak elikatzeko. Hala ere, isotopo honek uranio naturalean duen kontzentrazioa txikia denez, uranioak aberaste prozesu bat behar du nahiko uranio-235 egon dadin. Uranio-238 fisionagarria ere bada neutroi azkarren bidez, eta baita ere emankorra da plutonio-239 isotopoan bilakatu daitekeelako erreaktore nuklear batean. Uranio-233 isotopoa ere lortu daiteke torioa erabiliz, eta teknologia hau potentzialki erabili daiteke erreaktore nuklearrak egiteko. Uranio-238ak probabilitate txikia du fisio espontaneoa zein neutroi azkarrek induzitua jasateko, baina uranio-235 eta uranio-233ak probabilitate askoz handiagoa dute fisioa jasateko neutroi motelekin. Kontzentrazio aproposean, isotopo hauek fisio-kate egonkor bat jasan dezakete. Honek bero handia askatzen du, zentral nuklear zein arma nuklearren indarraren funtsa. Modu artifizialean uranio-238 bakarrik duen lagin bati uranio pobretua deritzo, eta armadura eta proiektil mota ezberdinetan erabiltzen da.
Uranioaren aurkikuntza 1789an Martin Heinrich Klaproth kimikari alemanari zor zaio, elementua izendatu zuena orduan aurkitu berria zen Urano planetaren ohorez. Eugène-Melchior Péligot izan zen metal moduan isolatu zuen lehena eta 1896an Henri Becquerel-ek aurkitu zituen bere ezaugarri erradioaktiboak. Otto Hahn, Lise Meitner, Enrico Fermi, Robert Oppenheimer eta bestelakoen ikerketek ahalbidetu zuten uranioaren erabilera zentral nuklearretan eta gerra batean lehen aldiz erabilitako arma nuklearran, Little Boy. Gerra Hotzan, Estatu Batuen eta Sobietar Batasunaren arteko lehiak milaka arma nuklear eraikitzea ekarri zuten, uranioa eta deribatutako plutonio-239 erabiliz. Hauek desarmatzea desarmatze nuklearren helburua da, milaka milioi dolar kostatzen duena. Hala ere, armetarako erabilgarria den kontzentrazioan dagoen uranio-235a diluitua izan daiteke uranio-238arekin, eta zentral nuklearretan erabilia izan elektrizitatea egiteko. Zentral nuklearren eraikuntza eta erabilera gora doan mundu mailan, izan ere elektrizitatea modu handian eta merkean sortzen baitute ia karbono dioxido isuririk gabe, berotze globala eragitea saihestuz. Ingurune eta osasunerako energia nuklearrak suposatzen duen arriskurik handiena erabilitako erregai nuklearra da, gehienbat uranio-238 dena uranio-235aren fisio produktuekin nahastuta.
Ezaugarri nagusiak
[aldatu | aldatu iturburu kodea]Uranioa (Metal zilarreztatua, ahula eta erradioaktiboa) naturan kontzentrazio txikietan azaltzen da, batez ere arroketan, uretan, lurrazalean eta izaki bizidunetan. Bere gogortasuna 6koa da Mohs-en eskalan. Oso dentsitate handia du (19,1 g/cm3)[2], berunarena baino handiagoa (11,3 g/cm3)[3] baina wolfram[4] eta urrearena (19,3 g/cm3)[5] baino txikiagoa.
Naturan, uranioak hiru isotopo ditu: 238U, 235U eta 234U. Naturan berez fisionagarria den isotoporik duen elementu bakarra; berezko isotopo fisionagarri bakar hori 235U da.

238U neutroi azkarrekin tratatuta da fisionagarria. 238U-ak berezko fisioa izateko probabilitate txikia du, edo neutroi azkarrek bonbardatzen dutenez, 235U-ak fisionatzeko probabilitate handiagoa du neutroi termikoek bonbardatzen dutenean. Hori dela eta, erreaktore nuklear batean beroa sortzeko erreakzio erantzule nagusia da, eta arma nuklearrentzat material fisiagarriaren iturri nagusia da.
Uraniozko metalak hiru forma alotropiko ditu:[6]
- α (kristal-sistema orthorhombic) egonkorra 668 °C arte. Orthorhombic, No espazio-taldea. 63, Cmcm, sareta-parametroak a = 285,4 pm, b = 587 pm, c = 495,5 pm. [7]
- β (kristal-sistema tetragonala) egonkorra, 668 °C-tik 775 °C-ra. Tetragonala, P42/mnm espazio-taldea, P42nm edo P4n2, sareta-parametroak a = 565,6 pm, b = c = 1075,9 pm.[7]
- y (kristal-sistema kubikoa), 775 °C-tik fusio-puntura; egoera hori da xaflagarriena eta harikorrena. Parametro kubikoa, gorputzean zentratutako sareta = 352.4 pm.[7]
Historia
[aldatu | aldatu iturburu kodea]Aurkikuntza
[aldatu | aldatu iturburu kodea]1789an, Martin Heinrich Klaproth kimikari alemaniarrak, Uranioa aurkitu zuen. Berlinen zuen laborategi esperimentalean lan egiten zuen bitartean, Klaproth-ek konposatu horia lortu zuen (ziur aski sodio diuranatoa), uraninita, azido nitrikoan disolbatu eta disoluzioa sodio hidroxidoarekin neutralizatzean. [8] Klaproth-ek onartu zuen substantzia horia oraindik aurkitu gabeko elementu baten oxidoa zela, eta ikatzez berotu zuen hauts beltza lortzeko, hauts hori uranio oxidoa zen. [8]
1841ean, Eugène-Melchior Péligot-ek, uranio-metalaren lehen lagina potasioarekin isolatu zuen. [8]

1896an, Henri Becquerelek, erradioaktibitatea aurkitu zuen, uranioa erabiliz.
Lehen Mundu Gerran, erdialdeko inperioak, molibdeno-eskasia izan zutenean, ohiko ferrouranio-aleazioak ordeztu zituzten, abiadura handiko tresnetarako, artilleriako kanoiak eta altzairuak egiteko. Praktika hori 1916an ezagutu zenean, Estatu Batuetako gobernuak, hainbat unibertsitate ospetsuri uraniorako erabilera horiek ikertzeko eskatu zien.
Formula horiekin egindako tresnak hainbat hamarkadatan erabili ziren, eta Manhattan Proiektuak eta Gerra Hotzak, fisioa ikertzeko eta armak garatzeko, uranioaren eskari handia jarri zutenean baino ez ziren amaitu.
Fisioaren ikerkuntza
[aldatu | aldatu iturburu kodea]1934an, Enrico Fermi buru zuen talde batek, ikusi zuen uranioa neutroiekin bonbardatzeak beta izpiak sortzen dituela. [9] Fisio-produktuak, hasieran, 93 eta 94 zenbaki atomikoak zituzten elementu berriekin nahastu ziren, eta Erromako Fakultateko dekano Orso Mario Corbinok ausonium eta hesperium izena jarri zion.[10]
Otto Hahnek eta Fritz Strassmannek uranioaren fisio-gaitasuna (bereiztea) aurkitzera eraman zituzten esperimentuak zuzendu zituzten.
1939an, Lise Meitnerrek eta haren ilobak, Otto Robert Frisch fisikariak, azalpen fisikoa argitaratu eta "fisio nuklearraren" prozesua izendatu zuten.[11]
Handik gutxira, Fermik hipotetizatu zuen, uranioaren fisioak fisio-erreakzio bati eusteko nahikoa neutroi aska ditzakeela. Hipotesi hori 1939an berretsi zen.[9]
Fermik, Alfred O. C. Nier bultzatu zuen uranio-isotopoak bereiztera fision-osagaia zehazteko, eta 1940a, Nierrek Minnesotako Unibertsitatean eraiki zuen tresna bat erabili zuen 235U lagina bereizteko.

Arma nuklearrak
[aldatu | aldatu iturburu kodea]Estatu Batuek, bi bonba atomiko mota nagusi garatu zituzten Bigarren Mundu Gerran. Bata, Uranioan oinarritutako gailua ("Little Boy" izenekoa), fisio-materiala uranio oso aberastua zuena, eta bestea, plutonioan oinarritutako gailua (ikus Trinity proba eta "Fat Man"), plutonioa 238U-tik eratorria zuena.
Uranioan oinarritutako Little Boy gailua, gerran erabilitako lehen arma nuklearra izan zen, 1945eko abuztuaren 6an, Hiroshima hiri japoniarrean detonatu zutenean. 12.500 tona TNTren pareko errendimenduarekin ustiatu zuena, eztandak eta ponparen olatu termikoak ia 50.000 eraikin suntsitu zituzten eta 75.000 pertsona inguru hil zituzten.[8] Hasiera batean uste zen uranioa nahiko arraroa zela, eta ugalketa nuklearra saihestu zitekeela.[12]
Erreaktoreak
[aldatu | aldatu iturburu kodea]X-10 grafito-erreaktorea,, lehen Clinton Pile eta X-10 Pile izenez ezaguna, Oak Ridge-ko Laborategi Nazionalean (ORNL) zegoen, munduko bigarren erreaktore nuklear artifiziala izan zen (Enrico Fermiren Chicago Pile-ren ondoren), eta etengabeko funtzionamendurako diseinatu eta eraikitako lehen erreaktorea izan zen.
1951n, Argonne Laborategi Nazionaleko Obtentoreko Erreaktore Esperimentala, elektrizitatea sortzeko lehen erreaktore nuklearra izan zen. [13] Hasieran, 150 watteko lau bonbilla piztu zituen erreaktoreak, baina, aldi baterako hobekuntzei esker, instalazio osoa elikatu ahal izan zuen (geroago, Arco hiria izan zen BORAX-III Argonneko Laborategi Nazionalak diseinatu eta operatutako beste erreaktore batek sortutako energia nuklearretik datorren elektrizitatea duen munduko lehena). [13] Munduko eskala komertzialeko lehen zentral nuklearra, Obninsk, Sobietar Batasunean, 1954ko ekainaren 27an hasi zen sortzen AM-1 erreaktorearekin.
Beste zentral nuklear goiztiar batzuk Calder Hall Ingalaterran, 1956an martxan jarri zuten,[14] eta Shippingporteko zentral nuklearra Pensilvanian, 1958an martxan jarri zuten izan ziren.
Historiaurreko fisio naturala
[aldatu | aldatu iturburu kodea]1972an, Francis Perrin, fisikari frantziarrak, fisio nuklear naturaleko 15 erreaktore zahar eta ez aktibo aurkitu zituen Gabongoko Oklo meatzean banandutako hiru mineral-aztarnategitan.
Mineral-biltegiak 1,7 mila milioi urte ditu; eta 235U Lurreko uranio guztiaren %3 ingurukoa izan zen.[15] Hori nahikoa handia da fisio nuklearreko katearen erreakzio iraunkorra gertatzeko, betiere beste laguntza-baldintza batzuk badaude.
Konposatuak
[aldatu | aldatu iturburu kodea]Oxidazio egoerak eta oxidoak
[aldatu | aldatu iturburu kodea]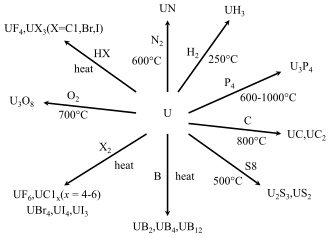
Oxidoak
[aldatu | aldatu iturburu kodea]Uranio kaltzinatutako opil horiak, errota handi askotan gertatzen den bezala, uranioaren oxidazio-espezieen banaketa hainbat formatan daude; gehiengo oxidaziotik oxidazio txikienera.
Kiskalgailu batean denbora laburrean egoten diren partikulak, normalean ez dira hainbeste oxidatuko, scrubber pilan denbora luzean baino. Uranioaren edukia U3O8ari dagokio.
U3O8a Manhattan proiektuaren egunetakoa da, U3O8 kimika analitikoko txostenen estandar gisa erabili zenean.
Uranio-oxigeno sistemako fase-erlazioak konplexuak dira. Uranioaren oxidazio-egoera garrantzitsuenak uranioa (IV) eta uranioa (VI) dira, eta horiei dagozkien bi oxidoak, uranio dioxidoa (UO2) eta uranio trioxidoa (UO3) dira.[9] Uranio-oxidoak ere badaude, hala nola, uranio-monoxidoa (UO), diuranio-pentoxidoa (U2O5) eta uranio-peroxidoa (UO4·2H2O).
Uranio oxidoaren formarik ohikoenak triuranio oktoxidoa (U3O8) eta uranio dioxioa (UO2) dira.[16] Bi oxido motak uretan disolbagarritasun txikia duten solidoak dira, eta nahiko egonkorrak ingurumen-baldintza askotan. Triuranio oktoxidea uranioaren konposaturik egonkorrena da (kondizioen arabera), eta naturan gehien aurkitzen den forma da. Uranio dioxidoa, uraneoaren erreaktore nuklear gisa, gehien erabiltzen den modua da.[16] Giro-tenperaturetan, UO2 pixkanaka U3O8ra aldatuko da.
Uraneoak duen egonkortasunagatik, uranio-oxidoak dira, oro har, metatzeko edo ezabatzeko forma kimiko gogokoenak.[16]
Uretako kimika
[aldatu | aldatu iturburu kodea]
Uranioaren oxidazio-egoera askotako gatzak uretan disolba daitezke eta ur-disoluzioetan azter daitezke. Forma ioniko ohikoenak hauek dira: U3+ (marroia), U4+ (berdea), UO2+ (ezegonkorra) eta U(O2)2+ (horia), U(III), U(IV), U(V) eta U(VI), hurrenez hurren. [9] Oxidazio formaleko uranio estatalerako konposatu solido eta erdi-metaliko batzuk daude, hala nola UO eta US, baina ez dakigu egoera horretarako disoluzioan dauden ioi sinpleak daudela. U3+ ioiek hidrogenoa uretatik askatzen dute, beraz, oso ezegonkorrak dira. U(O2)2+ ioiak uranio (VI)aren egoera adierazten du, eta uranil karbonatoa, uranilo kloruroa eta uranilo sulfatoa bezalako konposatuak eratzen ditu. [9]
Uranio-uraniloaren gatzek eta ioi poliatomikoen uranio-oxidoaren forma kationikoek ez bezala, uranatoak, uranio poliatomikoaren oxidoaren anioi bat duten gatzak, eskuarki ez dira uretan disolbatzen.
Karbonatoak
[aldatu | aldatu iturburu kodea]Karbonatozko anioien eta uranioaren (VI) arteko elkarreraginen ondorioz, Pourbaix-en diagrama asko aldatzen da, inguruneak karbonatoa duen soluzioa batera ura aldatzen duenean. Karbonato gehienak uretan disolbaezinak dira; uranio-karbonatoak, berriz, uretan disolbatzen dira maiz. U (VI) katioi batek bi amaierako oxido eta hiru karbonato edo gehiago elkar ditzakeelako gertatzen da hori, konplexu anionikoak eratzeko.
pH-aren ondorioak
[aldatu | aldatu iturburu kodea]Karbonatoak duten uranio-frakzioaren diagramek, argiago erakusten dute uranio-disoluzio baten pH-a handitzen denean, uranioa uranio-oxido hidratatu bihurtzen da, eta pHs altu, berriz, hidroxido anionikoaren konplexu.
Karbonatoa gehitzean, uranioa karbonato-konplexu bihurtzen da pHa handitzen bada. Erreakzio horien ondorioetako bat uranioaren disolbagarritasun handiagoa da pH 6 eta 8 artean, uranio dioxidoaren erregai nuklearren epe luzeko egonkortasunean eragin zuzena du.
Hidruroak, karburoak eta nitruroak
[aldatu | aldatu iturburu kodea]250 ºC-an berotutako uranio metalikoak (482 ºF-tik 572 °F-ra) hidrogenoarekin erreakzionatzen du uranio hidruroa sortzeko. Tenperatura altuagoek ere hidrogenoa deuseztatuko dute modu itzulgarrian. Propietate horri esker, uranio-hidruroak abiapuntuko material egokiak dira uranio erreaktiboko hautsa sortzeko, uranio-karburo, nitruro eta haluro konposatu batzuekin batera. Uranio hidruroaren bi kristal-aldaketa daude: tenperatura baxuetan lortzen den α forma, eta eratzen den tenperatura 250 °C-tik gorakoa denean sortzen den β forma.[9]
Uranio-karburoak eta uranio-nitruroak konposatu erdi-metaliko nahiko geldoak dira, eta oso gutxi disolbatzen dira azidoetan; urarekin erreakzionatzen dute, eta airean su har dezakete U3O8 sortzeko. [9] Uranio-karburoek uranio-monokarburoa (UC), uranio-dikarburoa (UC)2) eta diuranio trikarizatua (U2C3) UC eta UC3 uranio uranioari ikazkaia gehituz edo metala tenperatura alioxido karbonoa erabiliz sortzen dira. 1800 °C,U2C3tik beherako egonkor dagoenean, UC eta UC2 nahaste berotuak estres mekanikoa jasaten dute.[9] Metal nitrogenoaren esposizio zuzenaren bidez lortutako uranio nitruroek, uranio mononitruroa (NBE), uranio dinitruroa (ONU2) eta diuranio trinitruroa (U2N3).[9]

Haluroak
[aldatu | aldatu iturburu kodea]Uranio-fluoruro (UF) guztiak uranio-tetrafluoruroa (UF4) erabiliz sortzen dira; UF4, berez, uranio-dioxidoaren hidrofluperazidoaren bidez prestatzen da.[9] Hidrogeno bidezko UF4 erredukzioak, 1000 °C-an, uranio trifluoruroa (UF3) eragiten du. Tenperatura- eta presio-baldintza egokietan, UF solidoaren 4 konhexafluoruro uriogaseoso (UF4) erreakzioak U2F9, U4F17 eta UF5 bitarteko fluoruroak sor ditzake[9].
Erabilera
[aldatu | aldatu iturburu kodea]Militarra
[aldatu | aldatu iturburu kodea]
Sektore militarrean uranioaren aplikazio nagusia dentsitate handiko sartzaileetan dago. Munizioa %1-2ko aleazioa duen uranio pobretua da, titanioa edo molibdenoa kasuan.[17] Talka-abiadura handian, jaurtigaiaren dentsitateak, gogortasunak eta piroforikoteak erabat blindatutako helburuak suntsitzea ahalbidetzen dute.
Uranio pobretuaren erabilera polemiko eta ingurumenaren aldetik polemiko bihurtu zen Ameriketako Estatu Batuek munizio horiek erabili ondoren. Ameriketako Estatu Batuak, Erresuma Batuak eta Pertsiar Golkoko eta Balkanetako gerretan beste herrialde batzuek lurzoruan geratzen diren uranio-konposatuei buruzko galderak egin zituzten.
Uranio pobretua material erradioaktiboak biltegiratu eta garraiatzeko erabiltzen diren edukiontzi batzuetan ere erabiltzen da babes-material gisa. Metala berez erradioaktiboa bada ere, dentsitate handia duenez, beruna baino eraginkorrago bihurtzen da, erradiazio-iturrien moduko erradiazioa geldiarazteko. Uranio pobretuaren beste erabilera batzuk dira kontrapisuak aireontzien kontrol-gainazaletarako, hala nola misilak berriz sartzen diren ibilgailuetarako lasta eta babes-materiala.[18]
Material hori oso trinkoa denez, gida inertzialeko sistemetan eta iparrorratz giroskopikoetan aurkitzen da. Uranio pobretua nahiago da dentsitate bereko metalen gainean, erraz mekanizatu eta urtzeko gaitasuna duelako eta merkea delako.[8] Uranio pobretuaren eraginpean egoteko arrisku nagusia uranio oxido bidezko pozoitze kimikoa da, erradioaktibitatearen ordez.
Zibila
[aldatu | aldatu iturburu kodea]Uranioaren erabilera zibil nabarmenena zentral nuklearretan erabiltzen den energia termikoaren iturri da.

Sektore zibilean uranioaren erabilera nagusia zentral nuklearrak elikatzea da. Uranio235 kilogramo batek teorian 20 terajulio energia (2×1013 joule) inguru sor ditzake, fisio osoa dela joz; ikatzaren 1.5 milioi kilogramo (1,500 tona) adina energia. [8]

Energia nuklear komertzialeko instalazioek, erregaia erabiltzen dute, eta, normalean,% 3 inguru aberasten da uranio235.[8] CANDU eta Magnox diseinuak dira aberastu gabeko uranio-erregaia erabiltzeko gai diren erreaktore komertzial bakarrak. Estatu Batuetako itsas armadako erreaktoreetarako erabiltzen den erregaia uranio235ean aberastu ohi da (balio zehatzak honela sailkatzen dira). Erreaktore erreproduzitzaile batean uranio238 ere plutonio bihur daiteke.[18]
Erradioaktibitatea aurkitu aurretik, uranioa kantitate txikitan erabili zen beira horirako eta zeramikazko esmalteetarako; hala nola, uraniozko kristala eta baxerak egiteko.
Marie Curiek uranio-minerala (uraninita) aurkitu eta isolatu zuenean, uranio-meatzaritza garatu zen erradiazioa ateratzeko, eta erlojuetan eta hegazkinen iluntasunean pintura distiratsuak egiteko erabili zen.
Gizakiaren esposizioa
[aldatu | aldatu iturburu kodea]Pertsona batek uranioaren eraginpean egon daiteke, airean, hautsa arnastuz edo uretan, eta elikagai kutsatuak irentsiz.
Uranio-kopurua airean oso txikia izaten da; hala ere, fosfato-ongarriak prozesatzen dituzten lantegietan lan egiten duten pertsonak, arma nuklearrak egin edo probatu zituzten. Uranio-arma pobretuak erabili diren borroka-eremu moderno batetik hurbil bizi edo lan egiten dute, edo ikatz-energiako instalazio batetik hurbil bizi edo lan egiten dute, uranio-erregai minerala mehetu edo prozesatzeko.
Irentsitako uranio gehiena, naturaltasunez iraizten da. Uranio-forma disolbaezinak, hala nola, oxidoa, irensten direnean, %0,5 baino ez da xurgatzen; uranil ioi disolbagarrienak, berriz, %5erainokoak izan daitezke.[8] Uranio-konposatu disolbagarriek, hala ere, azkar igarotzen dira gorputz osotik; uranio-konposatu disolbaezinak, berriz, uranio-konposatuak, bereziki biriketan hautsa arnasten denean, arrisku larriagoa dute. Odolean sartu ondoren, xurgatutako uranioak, urte askoan biometaketa egiteko eta hezur-ehunetan egoteko joera du, fosfatoen uranio-afinitatearen ondorioz.[8] Uranioa ez da larruazalaren bidez xurgatzen, eta uranioaren askatutako alfa partikulak ezin dira larruazalean sartu.
Ondorioak
[aldatu | aldatu iturburu kodea]Uranioaren eraginpean egoteak giltzurrunaren, burmuinaren, gibelaren, bihotzaren eta beste sistema batzuen ohiko funtzionamenduari eragin diezaioke; izan ere, nahiko erradioaktiboa izateaz gain, uranioa oso metal toxikoa da, baita kantitate txikitan ere.[8][19]
Uranioa, ugalketarako ere toxikoa da. Ondorio erradiologiko lokalak izan ohi dira, U238 deskonposatzeko modu nagusiak, oso helmen laburra baitu eta ez baita azalean sartzen. Uranio-konposatuak, oro har, gaizki xurgatzen ditu biriketako estaldurak, eta arrisku erradiologikoa izaten jarrai dezakete denbora mugarik gabe.
UO2+ uranilo ioiek, hala nola uranil edo nitrato ioiek, frogatu dute jaiotza- eta kalteak eragin dizkiotela animalen sistema immunitarioari ,[20] CDCk, berriz, azterlan bat argitaratu du, eta ez da frogatu inolako minbizirik gizakietan, hondamendi naturaletarako esposizioaren ondorioz.
Ereferentziak
[aldatu | aldatu iturburu kodea]- ↑ The Chemistry of the Actinide and Transactinide Elements: Third Edition by L.R. Morss, N.M. Edelstein, J. Fuger, eds. (Netherlands: Springer, 2006.)
- ↑ (Ingelesez) "Uranio". Royal Socity of Chemistry.
- ↑ "Lead". Royal Society of Chemistry.
- ↑ "Tungsten", Royal Society of Chemistry
- ↑ "Gold". Royal Society of Chemistry.
- ↑ Rollett, A. D. (2008). Applications of Texture Analysis. John Wiley and Sons. p. 108. ISBN 978-0-470-40835-3.
- ↑ a b c The Chemistry of the Actinide and Transactinide Elements (PDF)
- ↑ a b c d e f g h i j Emsley, John (2001). "Uranium". Nature's Building Blocks: An A to Z Guide to the Elements. Oxford: Oxford University Press. pp. 476–482. ISBN 978-0-19-850340-8.
- ↑ a b c d e f g h i j k Seaborg, Glenn T. (1968). "Uranium". The Encyclopedia of the Chemical Elements. Skokie, Illinois: Reinhold Book Corporation.
- ↑ Fermi, Enrico (1938). "Artificial radioactivity produced by neutron bombardment: Nobel Lecture" (PDF).
- ↑ Meitner, L. and Frisch, O. (1939). "Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction"
- ↑ Helmreich, J.E. (1943) Gathering Rare Ores: The Diplomacy of Uranium Acquisition
- ↑ a b Charles E. Till and Yoon Chang, “Plentiful Energy: The Story of the Integral Fast Reactor”
- ↑ BBC News. (1956) "1956:Queen switches on nuclear power"
- ↑ "Oklo: Natural Nuclear Reactors". Hondakin Erradiaktiboen Kudeaketa Zibilaren Bulegoa. (2004)
- ↑ a b c Argonne National Laboratory. (2006) "Chemical Forms of Uranium"
- ↑ "Development of DU Munitions". Depleted Uranium in the Gulf (II). Gulflink. 2000
- ↑ a b Hammond, C. R. (2000). "The Elements, in Handbook of Chemistry and Physics" (PDF)
- ↑ «Toxicological Profile for Uranium» (PDF)
- ↑ Domingo, J. (2001) "Reproductive and developmental toxicity of natural and depleted uranium: a review"