Citohrom P450
| Citohrom P450 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura lanosterol 14α-demetilaze (CYP51) | |||||||||
| Identifikatori | |||||||||
| Simbol | p450 | ||||||||
| Pfam | PF00067 | ||||||||
| InterPro | IPR001128 | ||||||||
| PROSITE | PDOC00081 | ||||||||
| SCOP2 | 2cpp / SCOPe / SUPFAM | ||||||||
| OPM superporodica | 39 | ||||||||
| OPM protein | 2bdm | ||||||||
| CDD | cd00302 | ||||||||
| Membranom | 265 | ||||||||
| |||||||||
Citohromi P450 (CYP) su natporodica enzima koji sadrže hem kao kofaktor koji funkcioniraju kao monooksigenaze.[1][2][3] Kod sisara, ovi proteini oksidiraju steroide, masne kiseline i ksenobiotike, a važni su i za klirens različitih spojeva, kao i što se tiče sinteze i raspada hormona. Godine 1963. Estabrook, Cooper i Rosenthal opisali su ulogu CYP kao katalizatora u sintezi steroidnih hormona i metabolizmu lijekova. U biljkama, ovi proteini su važni za biosintezu odbrambenih spojeva, masnih kiselina i hormona.[2]
CYP enzimi su identificirani u svim carstvima života: životinje, biljke, gljive, protisti, bakterije, i archaea, kao i u virusima.[4] Međutim, oni nisu sveprisutni; naprimjer, nisu pronađeni u Escherichia coli.[3][5] Od 2018., poznato je više od 300.000 različitih CYP proteina.[6][7]
CYP su, općenito, terminalni enzimi oksidaze u lancima transfera elektrona, široko kategorizirani kao sistemi koji sadrže P450. Termin "P450" je izveden iz spektrofotometrijskog vrha na talasnoj dužini apsorpcionog maksimuma enzima (450 nm) kada je nalazi se u redukovanom stanju i u kompleksu sa ugljik-monoksidom. Većina CYP zahtijeva proteinskog partnera da isporuči jedan ili više elektrona, kako bi se smanjilo gvožđe (i na kraju molekulski kisik).
Nomenklatura
[uredi | uredi izvor]Genikoji kodiraju CYP enzime, i sami enzimi, označeni imaju korijenski simbol CYP za natporodicu, nakon čega slijedi broj koji označava porodicu gena, veliko slovo koje označava potporodicu i još jedan broj za pojedinačni gen. Konvencija je da se piše kurzivno ime kada se odnosi na gen. Naprimjer, CYP2E1 je gen koji kodira enzim CYP2E1—jedan od enzima uključenih u metabolizam paracetamola (acetaminofena). Nomenklatura CYP je zvanična konvencija o imenovanju, iako se kao povremeno koristi sinonim CYP450 ili CYP450. Međutim, neki nazivi gena ili enzima za CYP mogu se razlikovati od ove nomenklature, označavajući katalitsku aktivnost i naziv spoja koji se koristi kao supstrat. Primjeri uključuju CYP5A1, tromboksan A2-sintazu, skraćeno TBXAS1 (ThromBoXane A2 Synthase 1), i CYP51A1, lanosterol 14-α-demetilaza, ponekad nezvanično skraćeno LDM, prema njenom supstratu (Lanosterol) i aktivnosti (DeMetilacija).[8]
Sadašnje smjernice za nomenklaturu sugeriraju da članovi novih CYP porodica dijele najmanje 40% aminokiselinskog identiteta, dok članovi potporodica moraju dijeliti najmanje 55% aminokiselinskog identiteta. Nomenklaturne komisije dodjeljuju i prate oba osnovna imena gena (Cytochrome P450 Homepage) i alelna imena (CYP Komitet za alelnu nomenklaturu).[9][10]
Klasifikacija
[uredi | uredi izvor]

Na osnovu prirode proteina za prijenos elektrona, CYP se mogu klasificirati u nekoliko grupa:[11]
- Mikrosomni P450 sistemi
- u kojima se elektroni prenose sa nikotinamid adenin dinukleotid-fosfat preko citohrom P450-reduktaze (različito CPR, POR ili CYPOR). Citohrom b5 (cyb5) također može doprinijeti smanjenju snage ovog sistema nakon što je reduciran putem citohrom b5-reduktaze (CYB5R).
- Mitohondrijski P450 sistemi
- koji koriste adrenodoksin-reduktazu i adrenodoksin za prijenos elektrona sa NADPH na P450.
- Bakterijski P450 sistemi
- koji koriste feredoksin-reduktazu i feredoksin za prijenos elektrona na P450.
- CYB5R/cyb5/P450 sistemi
- u kojima oba elektrona potrebna za CYP dolaze iz citohroma b5.
- FMN/Fd/P450 sistemi
- izvorno pronađeni u vrstama roda Rhodococcus, kod kojih je FMN-domen koji sadrži reduktazu spojen sa CYP.
- P450 sami sistemi
- koji ne zahtijevaju eksternu redukcijsku snagu. Značajne su tromboksan-sintaza (CYP5), prostaciklin-sintaza (CYP8) i CYP74A (alen-oksid sintaza).
Najčešća reakcija koju kataliziraju citohromi P450 je reakcija monooksigenaze, npr. umetanje jednog atoma kisika u alifatski položaj organskog supstrata (RH), dok se drugi atom kisika reducira u vodu: <centar> RH + O2 + NADPH + H+ → ROH + H2O + NADP+
Mnoge reakcije hidroksilacija (ubacivanje hidroksil grupa) koriste CYP enzime.
Mehanizam
[uredi | uredi izvor]
Struktura
[uredi | uredi izvor]Aktivno mjesto citohroma P450 sadrži centar hemskog gvožđa. Gvožđe je vezano za protein preko cistein tiolatskog liganda. Ovaj cistein i nekoliko pratećih ostataka su visoko konzervirani u poznatim CYP-ima i imaju formalni PROSITE obrazac konsenzusa potpisa [FW] - [SGNH] – x – [GD] – {F} – [RKHPT] – {P} – C – [LIVMFAP] – [GAD].[12] Zbog velike raznolikosti reakcija koje kataliziraju CYP, aktivnosti i svojstva mnogih CYP se razlikuju u mnogim aspektima.[13] Općenito, katalitski ciklus P450 odvija se na sljedeći način:
Katalitski ciklus
[uredi | uredi izvor]- Supstrat se vezuje u blizini grupe hema, na strani suprotnoj od aksijalnog tiolata. Vezivanje supstrata izaziva promjenu u konformaciji aktivnog mjesta, često istiskujući molekulu vode iz distalnog aksijalnog koordinacionog položaja hemskog gvožđa,[14] i promjenu stanja hemskog gvožđa sa niskog na visoko-spinovano.[15]
- Vezivanje supstrata inducira prijenos elektrona iz NAD(P)H preko citohrom P450-reduktaze ili druge povezane reduktaze.[16]
- Molekulski kisik se vezuje za rezultujući centar hemskog gvožđa na distalnoj aksijalnoj koordinacionoj poziciji, u početku dajući dioksigenski adukt sličan oksi-mioglobinu.
- Drugi elektron se prenosi, bilo iz citohrom P450-reduktaze, feredoksina ili citohroma b5, smanjujući Fe-O2 adukta da bi se dobilo kratkotrajno perokso stanje.
- Perokso grupa formirana u 4. koraku brzo se protonira dvaput, oslobađajući jednu molekulu vode i formirajući visoko reaktivnu vrstu koja se naziva P450 Spoj 1 (ili samo spoj I). Ovaj visoko reaktivni intermedijer izolovan je 2010.[17] P450 spoj 1 je gvožđe(IV) okso (ili feril) vrsta sa dodatnim oksidacionim ekvivalentom delokalizovano preko porfirinskog i tiolatnog liganda. Dokazi za alternativni perferil gvožđe(V)-okso[14] nedostaju.[17]
- Ovisno o uključenom supstratu i enzimu, enzimi P450 mogu katalizirati bilo koju od širokog spektra reakcija. Na ovoj ilustraciji prikazana je hipotetSka hidroksilacija. Nakon što se proizvod oslobodi sa aktivnog mjesta, enzim se vraća u prvobitno stanje, a molekula vode se vraća i zauzima distalnu koordinacijsku poziciju gvožđevog jezgra.

- Alternativni put za monooksigenaciju je preko "peroksidnog šanta" (put "S" na slici). Ovaj put podrazumijeva oksidaciju kompleksa gvožđe-supstrat donorima atoma kisika kao što su peroksidi i hipohloriti.[18] Hipotetski peroksid "XOOH" je prikazan na dijagramu.
Spektroskopija
[uredi | uredi izvor]Vezivanje supstrata se ogleda u spektarskim svojstvima enzima, sa povećanjem apsorbancije na 390 nm i smanjenjem na 420 nm. Ovo se može izmjeriti spektroskopijom razlike i naziva se spektrom razlike "tip I" (pogledajte umetnuti grafikon na slici). Neki supstrati uzrokuju suprotnu promjenu spektarskih svojstava, "obrnuti tip I" spektra, procesima koji su još uvijek nejasni. Inhibitori i određeni supstrati koji se direktno vezuju za hemsko gvožđe dovode do spektra razlike tipa II, sa maksimumom na 430 nm i minimumom na 390 nm (pogledajte umetnuti grafikon na slici). Ako nema dostupnih redukcijskih ekvivalenata, ovaj kompleks može ostati stabilan, omogućavajući određivanje stepena vezivanja iz mjerenja apsorpcije in vitro[18] C: Ako se ugljik-monoksid (CO) veže na reducirani P450, katalitski ciklus se prekida. Ova reakcija daje klasični spektar razlike CO s maksimumom na 450 nm. Međutim, prekidni i inhibitorni efekti CO variraju u zavisnosti od različitih CYP tako da je porodica CYP3A relativno manje pogođena.[19]
P450 kod ljudi
[uredi | uredi izvor]Ljudski CYP su prvenstveno proteini povezani sa membranom [20] koji se nalaze ili u unutrašnjoj membrani mitohondrija ili u endoplazmatskom retikulumu ćelija. CYP metaboliziraju hiljade endogenih i egzogenih hemikalija. Neki CYP metaboliziraju samo jedan (ili vrlo malo) supstrata, kao što je CYP19 (aromataza), dok drugi mogu metabolisati više supstrata. Obje ove karakteristike objašnjavaju njihov centralni značaj u medicini. Enzimi citohroma P450 prisutni su u većini tkiva u tijelu i imaju važnu ulogu u sintezi i razgradnji hormona (uključujući sintezu estrogena i testosterona i metabolizam), sintezi holesterola, i metabolizam vitamina D. Enzimi citohroma P450 također funkcioniraju za metabolizam potencijalno toksičnih spojeva, uključujući lijekove i proizvode endogenog metabolizma kao što je bilirubin, uglavnom u jetri.
Projekt ljudskog genoma identifikovao je 57 ljudskih gena koji kodiraju različite enzime citohroma P450.[21]
Metabolizam lijekova
[uredi | uredi izvor]
CYP su glavni enzimi uključeni u metabolizam lijekova, koji čine oko 75% ukupnog metabolizma.[23] Većina lijekova se deaktivira pomoću CYP-a, bilo direktno ili olakšanim izlučivanjem iz tijela. Također, mnoge tvari se bioaktiviraju pomoću CYP-a, kako bi se formirali njihovi aktivni spojevi kao što su antitrombocitni lijek klopidogrel i opijat kodein.
Interakcija lijekova
[uredi | uredi izvor]Mnogi lijekovi mogu povećati ili smanjiti aktivnost različitih CYP izozima bilo indukcijom biosinteze izoenzima (indukcija enzima) ili direktnim inhibiranjem aktivnosti CYP (inhibicija enzima). Klasičan primjer uključuje antiepileptike, kao što je fenitoin, koji indukuje CYP1A2, CYP2C9, CYP2C19 i CYP3A4.
Efekti na aktivnost CYP izozima su glavni izvor štetnih interakcija lijekova, budući da promjene u aktivnosti enzima CYP mogu uticati na metabolizam i klirens različitih lijekova. Naprimjer, ako jedan lijek inhibira CYP-posredovan metabolizam drugog lijeka, drugi lijek se može akumulirati u tijelu do toksičnih nivoa. Stoga, ove interakcije lijekova mogu zahtijevati prilagođavanje doze ili odabir lijekova koji nemaju interakciju sa CYP sistemom. Takve interakcije lijekova posebno je važno uzeti u obzir kada se koriste lijekovi od vitalnog značaja za pacijenta, lijekovi sa značajnim nuspojavama ili lijekovi sa uskim terapijskim indeksom, ali svaki lijek može biti podložan do promijenjene koncentracije u plazmi zbog promijenjenog metabolizma lijeka.
Mnogi supstrati za CYP3A4 su lijekovi sa uskim terapeutskim indeksom, kao što je amiodaron[24] ili karbamazepin.[25] Budući da se ovi lijekovi metaboliziraju pomoću CYP3A4, srednji nivoi u plazmi ovih lijekova mogu se povećati zbog inhibicije enzima ili smanjiti zbog indukcije enzima.
Interakcija drugih supstanci
[uredi | uredi izvor]Prirodni spojevi mogu također inducirati ili inhibirati aktivnost CYP. Naprimjer, bioaktivni spoevi pronađena u soku grejpfruta i nekim drugim voćnim sokovima, uključujući bergamotin, dihidroksibergamotin i paradicin-A, bili su otkriveni da inhibiraju metabolizam određenih lijekova, posredovan CYP3A4, što dovodi do povećane bioraspoloživosti, a time i velike mogućnosti za predoziranje.[26] Zbog ovog rizika, obično se savjetuje potpuno izbjegavanje soka od grejpfruta i svježih grejpfruta dok se uzimaju lijekovi.[27]
- Ostali primjeri
- Kantarion, uobičajeni biljni lijek inducira CYP3A4, ali također inhibira CYP1A1, CYP1B1.[28][29]
- Pušenje inducira CYP1A2 (primjeri supstrata CYP1A2 su klozapin, olanzapin i fluvoksamin)[30]
- U relativno visokim koncentracijama, pokazalo se da sok zvezdano voće inhibira CYP2A6 i druge CYP.[31] Potočar je također poznati inhibitor citohroma P450 CYP2E1, što može dovesti do izmijenjenog metabolizma lijekova kod osoba koje uzimaju određene lijekove (npr. hlorzoksazon).[32]
- Utvrđeno je da tributiltin inhibira funkciju citohroma P450, što dovodi do maskulinizacije mehkušaca.[33]
- Zlatni pečat (žutika), sa svoja dva značajna alkaloida, berberin i hidrastin, pokazalo se da mijenja enzimske aktivnosti P450-markera (uključujući CYP2C9, CYP2D6 i CYP3A4).[34]
Ostale specifične funkcije CYP
[uredi | uredi izvor]Steroidni hormoni
[uredi | uredi izvor]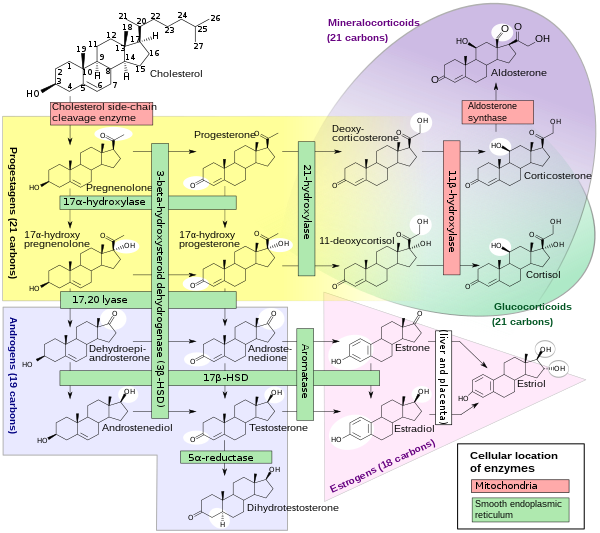
Podskup enzima citokroma P450 ima važnu ulogu u sintezi steroidnih hormona (steroidogeneza) od strane nadbubrežnih žlijezda, gonada i perifernog tkiva:
- CYP11A1 (također poznat kao P450scc ili P450c11a1) u nadbubrežnim mitohondrijama utiče na "aktivnost ranije poznatu kao 20,22-dezmolaza" (steroid 20α-hidroksilaza, steroid 22-hidroksilna hidroksilaza bočnog lanca).
- CYP11B1 (kodira protein P450c11β) koji se nalazi u unutrašnjoj mitohondrijalnoj membrani kore nadbubrežne žlijezde ima aktivnosti steroida 11β-hidroksilaze, steroida 18-hidroksilaza i 18-metiloksidaze .
- CYP11B2 (kodira protein P450c11AS), koji se nalazi samo u mitohondrijama zona glomerulosa nadbubrežne žlijezde, ima aktivnosti steroida 11β-hidroksilaze, steroida 18-hidroksilaze i steroida 18-metiloksidaze.
- CYP17A1, u endoplazmatskom retikulumu kore nadbubrežne žlijezde ima aktivnosti steroidne 17α-hidroksilaze i 17,20-lijaze.
- CYP21A2 (P450c21) u korteksu nadbubrežne žlijezde provodi aktivnost 21-hidroksilaze.
- CYP19A (P450arom, aromataza) u endoplazmatskom retikulumu gonada, mozga, masnog tkiva i drugdje katalizira aromatizaciju od androgena do estrogen.
Polinezasićene masne kiseline i eikozanoidi
[uredi | uredi izvor]Određeni enzimi citokroma P450 su kritični u metabolizmu polinezasićenih masnih kiselina (PUFA) u biološki aktivne, međućelijske ćelijskosignalizacijske molekule (eikozanoid) i/ili metaboliziraju biološki aktivne metabolite PUFA u manje aktivnih ili neaktivnih proizvoda. Ovi CYP poseduju aktivnost enzima citokrom P450 omega-hidroksilaza i/ili epoksigenaze.
- CYP1A1, CYP1A2 i CYP2E1 metaboliziraju endogene PUFA do signalnih molekula: metaboliziraju arahidonsku kiselinu (tj. AA) u 19-hidroksieikozatetraensku kiselinu (tj., vidi 19-HETE; 20-hidroksieikozatetraensku kiselinu); eikozapentaenska kiselina (tj. EPA) do epoksieikozatetraenske (tj. EEQ) i dokozaheksaenske kiseline (tj. DHA) do epoksidozapentaenska kiselina (tj. EDP).
- CYP2C8, CYP2C9, CYP2C18, CYP2C19, i CYP2J2 metaboliziraju endogene PUFA do signalnih molekula: metaboliziraju AA u epoksieikozatetraensku kiselinu (tj. EET); EPA do EEQ; i DHA u EDP.
- CYP2S1 metaboliše PUFA u signalne molekule: metaboliše AA u EET i EPA u EEQ.
- CYP3A4 metaboliše AA u EET signalne molekule.
- CYP4A11 metaboliše endogene PUFA u signalne molekule: metaboliše AA u 20-HETE i EET; takođe hidroksilira DHA u 22-hidroksi-DHA (tj. 12-HDHA).
- CYP4F2, CYP4F3A i CYP4F3B (vidi CYP4F3 za posljednja dva CYP) metaboliziraju PUFA do signalnih molekula: metaboliziraju AA u 20-HETE. Također metaboliziraju EPA u 19-hidroksieikozapentaensku kiselinu (19-HEPE) i 20-hidroksieikozapentaensku kiselinu (20-HEPE), kao i metaboliziraju DHA u 22-HDA. Oni također inaktiviraju ili smanjuju aktivnost signalnih molekula: metaboliziraju leukotrien B4 (LTB4) u 20-hidroksi-LTB4, 5-hidroksieikozatetraensku kiselinu (5-HETE) u 5,20-diHETE, 5-okso-eikozatetraensku kiselin (5-okso-ETE) do 5-okso,20-hidroksi-ETE, 12-hidroksieikozatetraensku kiselinu (12-HETE) do 12,20-diHETE, EETs do 20 -hidroksi-EETs i lipoksine do 20-hidroksi proizvoda.
- CYP4F8 i CYP4F12 metaboliziraju PUFA do signalnih molekula: metaboliziraju EPA u EEQ i DHA u EDP. Oni također metaboliziraju AA u 18-hidroksieikozatetraensku kiselinu (18-HETE) i 19-HETE.
- CYP4F11 inaktivira ili smanjuje aktivnost signalnih molekula: metabolizira LTB4 u 20-hidroksi-LTB4, (5-HETE) u 5,20-diHETE, (5-okso-ETE) u 5-okso,20 -hidroksi-ETE, (12-HETE) do 12,20-diHETE, EETs do 20-hidroksi-EETs, i lipoksins do 20-hidroksi proizvoda.
- CYP4F22 ω-hidroksilira ekstremno duge "masne kiseline veoma dugog lanca", tj. masne kiseline koje imaju 28 ili više ugljenika. ω-hidroksilacija ovih posebnih masnih kiselina je kritična za stvaranje i održavanje funkcije vodene barijere kože; autosomno recesivne inaktivirajuće mutacije CYP4F22 povezane su sa lamelstom ihtiozom podtipom kongenitalnog ihtioziformnog eritrodema kod ljudi.[36]
CYP porodice kod ljudi
[uredi | uredi izvor]Ljudi imaju 57 gena i više od 59 pseudogena podijeljenih između 18 porodica gena citohroma P450 i 43 potporodice.[37] Slijedi sažetak gena i proteina koje oni kodiraju. Za detaljne informacije, pogledajte početnu stranicu Komiteta za nomenklaturu citohroma P450.[21]
| Porodica | Funkcija | Članovi | Geni | Pseudogeni |
| CYP1 | Metabolizam lijekova i steroida (posebno estrogena), benzo[a]piren toksikacija (formiranje (+)-benzo[a]piren-7,8-dihidrodiol-9,10-epoksid) | 3 potporodice, 3 gena, jedan pseudogen | CYP1A1, CYP1A2, CYP1B1 | CYP1D1P |
| CYP2 | Metabolizam lijekova i steroida | 13 potporodica, 16 gena, 16 pseudogena | CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1 | Previše ih je nabrojati |
| CYP3 | Metabolizam lijekova i steroida (uključujući testosteron) | Jedna potporodica, 4 gena, 4 pseudogena | CYP3A4, CYP3A5, CYP3A7, CYP3A43 | CYP3A51P, CYP3A52P, CYP3A54P, CYP3A137P |
| CYP4 | Arahidonska kiselina ili metabolizam masnih kiselina | Šest potporodica, 12 gena, 10 pseudogena | CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z1 | Previše ih je nabrojati |
| CYP5 | tromboksan A2 sintaza | Jedna potporodica, jedan gen | CYP5A1 | |
| CYP7 | Žučna kiselina biosinteza 7-alfa hidroksilaze steroidnog jezgra | Dvije potporodice, dva gena | CYP7A1, CYP7B1 | |
| CYP8 | Raznovrsno | Dvije potporodice, dva gena | CYP8A1 (prostaciklin-sintaza), CYP8B1 (biosinteza žučne kiseline) | |
| CYP11 | Biosinteza steroida | Dvije potporodice, tri gena | CYP11A1, CYP11B1, CYP11B2 | |
| CYP17 | Biosinteza steroida, 17-alfa hidroksilaza | Jedna potporodica, jedan gen | CYP17A1 | |
| CYP19 | Biosinteza steroida: aromataza sintetizira estrogen | Jedna potporodica, jedan gen | CYP19A1 | |
| CYP20 | Nepoznata funkcija | Jedna potporodica, jedan gen | CYP20A1 | |
| CYP21 Biosinteza steroida | Jeddna potporodica, jedan gen, jedan pseudogen | CYP21A2 | CYP21A1P | |
| CYP24 | Degradacija vitamina D | Jedna potporodica, jedan gen | CYP24A1 | |
| CYP26 | Rwtinojskokiselinska hidroksilaza | Tri potporodice, tri gena | CYP26A1, CYP26B1, CYP26C1 | |
| CYP27 | Raznovrsno | Tri potporodice, tri gena | CYP27A1 (biosinteza žučne kiseline), CYP27B1 (vitamin D3 1-alfa hidroksilaza, aktivira vitamin D3), CYP27C1 (nepoznata funkcija) | |
| CYP39 | 7-Alfa hidroksilacija 24-hidroksiholesterola | Jedna potporodica, jedan gen | CYP39A1 | |
| CYP46 | Holesterolska 24-hidroksilaza | Jedna potporodicaa, jedan gen, jedan pseudogen | CYP46A1 | CYP46A4P |
| CYP51 | Biosinteza holesterola | Jedna potporodicaa, jedan gen, tri pseudogena | CYP51A1 (lanosterol 14-alfa demetilaza) | CYP51P1, CYP51P2, CYP51P3 |
P450 u ostalim vrstama
[uredi | uredi izvor]Životinje
[uredi | uredi izvor]Životinje često imaju više CYP gena nego ljudi. Prijavljeni brojevi kreću se od 35 gena u spužvi Amphimedon queenslandica do 235 gena u glavonožcu Branchiostoma floridae.[38] Miševi imaju gene za 101 CYP, a morski ježevi imaju čak i više (možda čak i 120 gena).[39] Pretpostavlja se da većina enzima CYP ima aktivnost monooksigenaza, kao što je slučaj s većinom CYP-ova sisara koji su ispitivani (osim, npr. CYP19 i CYP5). Gensko i genomsko sekvenciranje daleko nadmašuje biohemijsku karakterizaciju enzimske funkcije, iako su pronađeni mnogi geni s bliskom homologijom CYP-ima s poznatom funkcijom, što daje naznake njihove funkcionalnosti.
Klase CYP-a koje se najčešće istražuju kod životinja a koje nisu ljudi su one koje su uključene u razvoj (npr. metabolizam retinoinsk kiseline ili hormona ili uključene u metabolizam toksičnih spojeva (kao što su heterociklički amini ili poliaromatski ugljikovodici). Često postoje razlike u regulaciji gena ili enzimskoj funkciji CYP-a u srodnih životinja koje objašnjavaju uočene razlike u osjetljivosti na toksične spojeve (npr. nesposobnost pasa da metaboliziraju ksantine kao što je kofein). Neki lijekovi se metaboliziraju kod obje vrste putem različitih enzima, što rezultira različitim metabolitima, dok se drugi lijekovi metaboliziraju kod jedne vrste, ali se izlučuju nepromijenjeni kod druge. Iz tog razloga, reakcija jedne vrste na tvar nije pouzdan pokazatelj učinaka tvari na ljude. Vrsta sonorska pustunjska Drosophila koja koristi pojačanu ekspresiju CYP28A1 gena za detoksikaciju truhleži kaktusa je Drosophila mettleri. Mušice ove vrste prilagodile su pojačanu regulaciju ovog gena zbog izloženosti visokim razinama alkaloida u biljkama domaćinima.
CYP su opsežno ispitani kod miševa, pacova, pasa, a manje kod zebrica, kako bi se olakšala upotreba ovih modelnih organizama u otkrivanju lijekova i toksikologiji. Nedavno su CYP također otkriveni kod ptičjih vrsta, posebno purana, što bi se moglo pokazati korisnim modelom za istraživanje raka kod ljudi.[40] Utvrđeno je da su CYP1A5 i CYP3A37 u purana vrlo slični ljudskim CYP1A2, odnosno CYP3A4 u smislu njihovih kinetičkih svojstava kao i u metabolizmu aflatoksina B1.[41]
CYP su također intenzivno proučavani kod insekata, često kako bi se razumjela otpornost na pesticide. Naprimjer, CYP6G1 povezan je s otpornošću na insekticide u DDT-rezistentnoj Drosophila melanogaster[42] a CYP6M2 u vektoru malarijskog komarca Anopheles gambiae sposoban je izravno metabolizirati piretroide.[43]
Mikrobi
[uredi | uredi izvor]Mikrobni citohromi P450 često su topljivi enzimi i uključeni su u različite metaboličke procese. U bakterijama je distribucija P450 vrlo promjenjiva s mnogim bakterijama koje nemaju identificirane P450 (npr. E. coli). Neke bakterije, uglavnom aktinomicete, imaju brojne P450 (npr.[44][45]). Ovi koji su do sada identificirani općenito su uključeni ili u biotransformaciju ksenobiotskih spojeva (npr. CYP105A1 iz Streptomyces griseolus metabolizira sulfonilurejin herbicid u manje toksične derivate,[46]) ili su dio specijaliziranih biosintetskih puteva metabolita (npr. CYP170B1 katalizira proizvodnju seskviterpenoida albaflavenona u Streptomyces albus[47]). Iako se još nije pokazalo da je P450 neophodan u mikrobu, porodica CYP105 visoko je konzervirana s predstavnikom u svakom genomu streptomiceta koji je dosad sekvenciran.[48] Zbog topivosti bakterijskih enzima P450, općenito se smatra da je s njima lakše raditi nego s pretežno membranski vezanim eukariotskim P450. Ovo, u kombinaciji s izvanrednom hemijom koju kataliziraju, dovelo je do mnogih studija koje su koristile heterologno eksprimirane proteine in vitro. Malo je studija istraživalo što P450-ove radi in vivo, koji su prirodni supstrati i kako P450 doprinose preživljavanju bakterija u prirodnom okruženju. Ovdje su navedena tri primjera koji su značajno pridonijeli strukturnim i mehaničkim studijama, ali mnogo različitih obitelji postoje.
- Citohrom P450 cam (CYP101A1) izvorno iz Pseudomonas putida korišten je kao model za mnoge citohrome P450 i bio je prva trodimenzijska proteinska struktura citohroma P450 riješena rendgenskom kristalografijom. Ovaj enzim dio je katalitskog ciklusa hidroksilacije kamfora koji se sastoji od dva koraka prijenosa elektrona iz putidaredoksina, proteinskog kofaktora koji sadrži klaster 2Fe-2S.
- Citohrom P450 eryF (CYP107A1) porijeklom iz bakterije aktinomicete Saccharopolyspora erythraea odgovoran je za biosintezu antibiotika eritromicina C6-hidroksilacijom makrolida 6-dezoksieritronolida B.
- Citohrom P450 BM3 (CYP102A1) iz bakterije tla Bacillus megaterium katalizira NADPH-ovisnu hidroksilaciju nekoliko dugolančanih masnih kiselina na ω–1 do ω – 3 pozicije. Za razliku od gotovo svakog drugog poznatog CYP (osim CYP505A1, citohroma P450 foxy), on predstavlja prirodni fuzijski protein između CYP domena i kofaktora doniranja elektrona. Stoga je BM3 potencijalno vrlo koristan u biotehnološkim primjenama.[49][50]
- Citohrom P450 119 (CYP119A1) izoliran iz termofilne arheje Sulfolobus solfataricus [51] has been used in a variety of mechanistic studies.[17] Budući da su termofilni enzimi evoluirali da funkcioniraju na visokim temperaturama, imaju tendenciju da funkcionišu sporije na sobnoj temperaturi (ako uopće) i stoga su odlični mehanički modeli.
Gljive
[uredi | uredi izvor]Obično korišteni antgljivič lijekovi iz klase 2C triazol.2C i tiazolni deluju inhibicijom gljivične citohrom P450 14α-demetilaze. Ovo prekida konverziju lanosterola u ergosterol, komponentu gljivične ćelijske membrane. (Ovo je korisno samo zato što ljudski P450 ima drugačiju osjetljivost; ovako funkcionira ova klasa fungicida).[52]
U toku su značajna istraživanja gljivičnih P450, jer su brojne gljive patogene za ljude (kao što su Candida kvasac i Aspergillus) i do biljaka.
Cunninghamella elegans je kandidat za upotrebu kao modela za metabolizam lijekova kod sisara.
Biljke
[uredi | uredi izvor]Citohromi P450 su uključeni u različite procese rasta, razvoja i odbrane biljaka. Procjenjuje se da geni CYP P450 čine otprilike 1% biljnog genoma.[53][54] Ovi enzimi dovode do konjugata različitih masnih kiselina, biljnih hormona, sekundarnih metabolita, lignina i raznih odbrambenih spojeva.[55]
Citohrom P450 ima važnu ulogu u odbrani biljaka – uključenje u biosintezu fitoaleksina, metabolizam hormona i biosintezu različitih sekundarnih metabolita.[56] Ekspresija gena citohroma p450 regulirana je kao odgovor na stresove okoline što ukazuje na ključnu ulogu u odbrambenim mehanizmima biljaka.[57]
Pokazalo se da su fitoaleksini važni u odbrambenim mehanizmima biljaka jer su antimikrobni sojevi koje biljke proizvode kao odgovor na biljne patogene. Fitoaleksini nisu specifični za patogene, već su specifični za biljke; svaka biljka ima svoj jedinstveni set fitoaleksina. Međutim, oni i dalje mogu napadati širok spektar različitih patogena. Arabidopsis je biljka blisko povezana sa kupusom i senfom i proizvodi fitoaleksin kamaleksin. Kamaleksin potiče od triptofana i njegova biosinteza uključuje pet enzima citohroma P450. Pet enzima citokroma P450 uključuju CYP79B2, CYP79B3, CYP71A12, CYP71A13 i CYP71B15. Prvi korak biosinteze kamaleksina proizvodi indol-3-acetaldoksim (IAOx) iz triptofana i katalizira ga CYP79B2 ili CYP79B3. IAOx se zatim odmah pretvara u indol-3-acetonitril (IAN) i kontrolira ga ili CYP71A13 ili njegov homolog CYP71A12. Posljednja dva koraka puta biosinteze kamaleksina katalizira CYP71B15. U ovim koracima, indol-3-karboksilna kiselina (DHCA) formira se iz cistein-indol-3-acetonitrila (Cys(IAN), nakon čega slijedi biosinteza kamaleksina. Postoje neki međukoraci unutar puta koji ostaju nejasni, ali se dobro razumije da je citohrom P450 ključan u biosintezi kamaleksina i da ovaj fitoaleksin ima glavnu ulogu u odbrambenim mehanizmima biljaka.[58]
Citohrom P450 je u velikoj mjeri odgovoran za sintezu jasmonske kiseline (JA), uobičajene hormonske odbrane od abiotskih i biotskih stresova za biljne ćelije. Naprimjer, P450, CYP74A uključen je u reakciju dehidracije za proizvodnju nezasićeng alen-oksida iz hidroperoksida.[59] JA hemijske reakcije su kritične u prisustvu biotskih stresova koji mogu biti uzrokovani ranjavanjem biljaka, posebno prikazano u biljci Arabidopsis. Kao prohormon, jasmonska kiselina mora biti pretvorena u konjugat JA-izoleucina (JA-Ile) JAR1 katalizacijom da bi se smatrala aktiviranom. Zatim, JA-Ile sinteza dovodi do sklapanja koreceptorskog kompleksa sastavljenog od COI1 i nekoliko JAZ proteina. U uslovima niske JA-Ile, JAZ proteinske komponente djeluju kao transkripcijski represori za suzbijanje nizvodnih JA gena. Međutim, pod adekvatnim JA-Ile uslovima, JAZ proteini su ubikvitinirani i podvrgnuti degradaciji kroz 26S proteazom, što rezultira funkcionalnim efektima nizvodno. Nadalje, nekoliko CYP94 (CYP94C1 i CYP94B3) povezano je sa prometom JA-Ile i pokazuje da JA-Ile oksidacijski status utiče na signalizaciju biljaka na katabolitski način.[53] Izvanredna reaktivnost i promiskuitet supstrata P450 dugo su privlačili pažnju hemičara.[60] Nedavni napredak ka ostvarivanju potencijala upotrebe P450 za teške oksidacije uključivao je: (1) eliminaciju potrebe za prirodnim kofaktorima zamjenom ih jeftinim molekulama koji sadrže peroksid,[61](2) istraživanje kompatibilnosti P450 sa organskim rastvaračima,[62] i (3) korištenje malih, nehiralnih pomoćnih sredstava za predvidljivo usmjeravanje oksidacije P450.
InterPro potporodice
[uredi | uredi izvor]InterPro potporodice:
- Citoc+hrom P450, B-klasa InterPro: IPR002397
- Citohrom P450, mitohondrijski InterPro: IPR002399
- Citohromeđ P450, E-klasa, grupa I InterPro: IPR002401
- Citohhrom P450, E-klasa, grupa II InterPro: IPR002402
- Citohhrom P450, E-klasa, grupa IV InterPro: IPR002403
- Aromataza
Klozapin, imipramin, paracetamol, fenacetin Heterociklički aril amini Inducibilan i CYP1A2 5-10% deficit oksidiraju uroporfirinogen u uroporfirin (CYP1A2) u metabolizmu hema, ali mogu imati dodatne neotkrivene endogene supstrate. mogu se inducirati nekim policikličkim ugljikovocima, od kojih se neki nalaze u dimu cigareta i ugljenisanoj hrani.
Ovi enzimi su od interesa, jer u testovima mogu aktivirati spojevima na karcinogene. Visoki nivoi CYP1A2 povezani su s povećanim rizikom od raka debelog crijeva. Budući da se enzim 1A2 može inducirati pušenjem cigareta, to povezuje pušenje s rakom debelog crijeva.[63]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Gonzalez FJ, Gelboin HV (novembar 1992). "Human cytochromes P450: evolution and cDNA-directed expression". Environmental Health Perspectives. 98: 81–85. doi:10.1289/ehp.929881. PMC 1519618. PMID 1486867.
- ^ a b "Cytochrome P450". InterPro.
- ^ a b Danielson PB (decembar 2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Current Drug Metabolism. 3 (6): 561–597. doi:10.2174/1389200023337054. PMID 12369887.
- ^ Lamb DC, Lei L, Warrilow AG, Lepesheva GI, Mullins JG, Waterman MR, Kelly SL (august 2009). "The first virally encoded cytochrome p450". Journal of Virology. 83 (16): 8266–8269. doi:10.1128/JVI.00289-09. PMC 2715754. PMID 19515774.
- ^ Sigel A, Sigel H, Sigel RK (2007). The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. New York: Wiley. ISBN 978-0-470-01672-5.
- ^ Nelson DR (januar 2018). "Cytochrome P450 diversity in the tree of life". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1866 (1): 141–154. doi:10.1016/j.bbapap.2017.05.003. PMC 5681887. PMID 28502748.
- ^ Nelson DR (oktobar 2009). "The cytochrome p450 homepage". Human Genomics. University of Tennessee. 4 (1): 59–65. doi:10.1186/1479-7364-4-1-59. PMC 3500189. PMID 19951895.
- ^ "NCBI sequence viewer". Pristupljeno 19. 11. 2007.
- ^ Nelson DR (oktobar 2009). "The cytochrome p450 homepage". Human Genomics. 4 (1): 59–65. doi:10.1186/1479-7364-4-1-59. PMC 3500189. PMID 19951895.
- ^ Nelson DR (januar 2011). "Progress in tracing the evolutionary paths of cytochrome P450". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (1): 14–18. doi:10.1016/j.bbapap.2010.08.008. PMID 20736090.
- ^ Hanukoglu I (1996). "Electron transfer proteins of cytochrome P450 systems" (PDF). Adv. Mol. Cell Biol. Advances in Molecular and Cell Biology. 14: 29–55. doi:10.1016/S1569-2558(08)60339-2. ISBN 9780762301133.
- ^ [1] Arhivirano 18. 10. 2019. na Wayback MachinePROSITE obrazac konsenzusa za P450
- ^ Srinivasan B (mart 2021). "Explicit Treatment of Non-Michaelis-Menten and Atypical Kinetics in Early Drug Discovery*". ChemMedChem. 16 (6): 899–918. doi:10.1002/cmdc.202000791. PMID 33231926. S2CID 227157473.
- ^ a b Meunier B, de Visser SP, Shaik S (septembar 2004). "Mechanism of oxidation reactions catalyzed by cytochrome p450 enzymes". Chemical Reviews. 104 (9): 3947–3980. doi:10.1021/cr020443g. PMID 15352783. S2CID 33927145.
- ^ Poulos TL, Finzel BC, Howard AJ (juni 1987). "High-resolution crystal structure of cytochrome P450cam". Journal of Molecular Biology. 195 (3): 687–700. doi:10.1016/0022-2836(87)90190-2. PMID 3656428.
- ^ Sligar SG, Cinti DL, Gibson GG, Schenkman JB (oktobar 1979). "Spin state control of the hepatic cytochrome P450 redox potential". Biochemical and Biophysical Research Communications. 90 (3): 925–932. doi:10.1016/0006-291X(79)91916-8. PMID 228675.
- ^ a b c Rittle J, Green MT (novembar 2010). "Cytochrome P450 compound I: capture, characterization, and C-H bond activation kinetics". Science. 330 (6006): 933–937. Bibcode:2010Sci...330..933R. doi:10.1126/science.1193478. PMID 21071661. S2CID 206528205.
- ^ a b Ortiz de Montellano PR (2005). Cytochrome P450: structure, mechanism, and biochemistry (3rd izd.). New York: Kluwer Academic/Plenum Publishers. ISBN 978-0-306-48324-0.
- ^ Hopper CP, Zambrana PN, Goebel U, Wollborn J (juni 2021). "A brief history of carbon monoxide and its therapeutic origins". Nitric Oxide. 111–112: 45–63. doi:10.1016/j.niox.2021.04.001. PMID 33838343. S2CID 233205099.
- ^ Berka K, Hendrychová T, Anzenbacher P, Otyepka M (oktobar 2011). "Membrane position of ibuprofen agrees with suggested access path entrance to cytochrome P450 2C9 active site". The Journal of Physical Chemistry A. 115 (41): 11248–11255. Bibcode:2011JPCA..11511248B. doi:10.1021/jp204488j. PMC 3257864. PMID 21744854.
- ^ a b "P450 Table". 8. 4. 2021.
- ^ doctorfungus > Antifungal Drug Interactions Arhivirano 1. 8. 2012. na: Archive.today Content Director: Russell E. Lewis, Pharm.D. Retrieved on Jan 23, 2010
- ^ Guengerich FP (januar 2008). "Cytochrome p450 and chemical toxicology". Chemical Research in Toxicology. 21 (1): 70–83. doi:10.1021/tx700079z. PMID 18052394. S2CID 17548932. (Metabolism in this context is the chemical modification or degradation of drugs.)
- ^ Zahno A, Brecht K, Morand R, Maseneni S, Török M, Lindinger PW, Krähenbühl S (februar 2011). "The role of CYP3A4 in amiodarone-associated toxicity on HepG2 cells". Biochemical Pharmacology. 81 (3): 432–441. doi:10.1016/j.bcp.2010.11.002. PMID 21070748.
- ^ "Carbamazepine: Watch for Many Potential Drug Interactions". Pharmacy Times. Arhivirano s originala, 14. 10. 2020. Pristupljeno 23. 9. 2022.
- ^ Bailey DG, Dresser GK (2004). "Interactions between grapefruit juice and cardiovascular drugs". American Journal of Cardiovascular Drugs. 4 (5): 281–297. doi:10.2165/00129784-200404050-00002. PMID 15449971. S2CID 11525439.
- ^ Zeratsky K (6. 11. 2008). "Grapefruit juice: Can it cause drug interactions?". Ask a food & nutrition specialist. MayoClinic.com. Pristupljeno 9. 2. 2009.
- ^ Chaudhary A, Willett KL (januar 2006). "Inhibition of human cytochrome CYP 1 enzymes by flavonoids of St. John's wort". Toxicology. 217 (2–3): 194–205. doi:10.1016/j.tox.2005.09.010. PMID 16271822.
- ^ Strandell J, Neil A, Carlin G (februar 2004). "An approach to the in vitro evaluation of potential for cytochrome P450 enzyme inhibition from herbals and other natural remedies". Phytomedicine. 11 (2–3): 98–104. doi:10.1078/0944-7113-00379. PMID 15070158.
- ^ Kroon LA (septembar 2007). "Drug interactions with smoking". American Journal of Health-System Pharmacy. 64 (18): 1917–1921. doi:10.2146/ajhp060414. PMID 17823102. S2CID 5397510.
- ^ Zhang JW, Liu Y, Cheng J, Li W, Ma H, Liu HT, et al. (2007). "Inhibition of human liver cytochrome P450 by star fruit juice". Journal of Pharmacy & Pharmaceutical Sciences. 10 (4): 496–503. doi:10.18433/j30593. PMID 18261370.
- ^ Leclercq I, Desager JP, Horsmans Y (august 1998). "Inhibition of chlorzoxazone metabolism, a clinical probe for CYP2E1, by a single ingestion of watercress". Clinical Pharmacology and Therapeutics. 64 (2): 144–149. doi:10.1016/S0009-9236(98)90147-3. PMID 9728894. S2CID 43863786.
- ^ Walmsley S. "Tributyltin pollution on a global scale. An overview of relevant and recent research: impacts and issues" (PDF). WWF UK. Arhivirano s originala (PDF), 7. 4. 2014. Pristupljeno 23. 9. 2022.
- ^ Chatterjee P, Franklin MR (novembar 2003). "Human cytochrome p450 inhibition and metabolic-intermediate complex formation by goldenseal extract and its methylenedioxyphenyl components". Drug Metabolism and Disposition. 31 (11): 1391–1397. doi:10.1124/dmd.31.11.1391. PMID 14570772. S2CID 2967171.
- ^ Häggström M, Richfield D (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Sugiura K, Akiyama M (juli 2015). "Update on autosomal recessive congenital ichthyosis: mRNA analysis using hair samples is a powerful tool for genetic diagnosis". Journal of Dermatological Science. 79 (1): 4–9. doi:10.1016/j.jdermsci.2015.04.009. PMID 25982146.
- ^ Nelson D (2003). Cytochromes P450 in humans. Retrieved May 9, 2005.
- ^ Nelson DR, Goldstone JV, Stegeman JJ (februar 2013). "The cytochrome P450 genesis locus: the origin and evolution of animal cytochrome P450s". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1612): 20120474. doi:10.1098/rstb.2012.0474. PMC 3538424. PMID 23297357.
- ^ Goldstone JV, Hamdoun A, Cole BJ, Howard-Ashby M, Nebert DW, Scally M, et al. (decembar 2006). "The chemical defensome: environmental sensing and response genes in the Strongylocentrotus purpuratus genome". Developmental Biology. 300 (1): 366–384. doi:10.1016/j.ydbio.2006.08.066. PMC 3166225. PMID 17097629.
- ^ Rawal S, Kim JE, Coulombe R (decembar 2010). "Aflatoxin B1 in poultry: toxicology, metabolism and prevention". Research in Veterinary Science. 89 (3): 325–331. doi:10.1016/j.rvsc.2010.04.011. PMID 20462619.
- ^ Rawal S, Coulombe RA (august 2011). "Metabolism of aflatoxin B1 in turkey liver microsomes: the relative roles of cytochromes P450 1A5 and 3A37". Toxicology and Applied Pharmacology. 254 (3): 349–354. doi:10.1016/j.taap.2011.05.010. PMID 21616088.
- ^ McCart C, Ffrench-Constant RH (juni 2008). "Dissecting the insecticide-resistance- associated cytochrome P450 gene Cyp6g1". Pest Management Science. 64 (6): 639–645. doi:10.1002/ps.1567. PMID 18338338. S2CID 41480564.
- ^ Ismail HM, O'Neill PM, Hong DW, Finn RD, Henderson CJ, Wright AT, et al. (decembar 2013). "Pyrethroid activity-based probes for profiling cytochrome P450 activities associated with insecticide interactions". Proceedings of the National Academy of Sciences of the United States of America. 110 (49): 19766–19771. Bibcode:2013PNAS..11019766I. doi:10.1073/pnas.1320185110. PMC 3856776. PMID 24248381.
- ^ McLean KJ, Clift D, Lewis DG, Sabri M, Balding PR, Sutcliffe MJ, et al. (maj 2006). "The preponderance of P450s in the Mycobacterium tuberculosis genome". Trends in Microbiology. 14 (5): 220–228. doi:10.1016/j.tim.2006.03.002. PMID 16581251.
- ^ Ikeda H, Ishikawa J, Hanamoto A, Shinose M, Kikuchi H, Shiba T, et al. (maj 2003). "Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis". Nature Biotechnology. 21 (5): 526–531. doi:10.1038/nbt820. PMID 12692562.
- ^ O'Keefe DP, Romesser JA, Leto KJ (1988). "Identification of constitutive and herbicide inducible cytochromes P-450 in Streptomyces griseolus". Archives of Microbiology. Springer Science+Business. 149 (5): 406–412. doi:10.1007/bf00425579. ISSN 0302-8933. S2CID 35526991.
- ^ Moody SC, Zhao B, Lei L, Nelson DR, Mullins JG, Waterman MR, et al. (maj 2012). "Investigating conservation of the albaflavenone biosynthetic pathway and CYP170 bifunctionality in streptomycetes". The FEBS Journal. 279 (9): 1640–1649. doi:10.1111/j.1742-4658.2011.08447.x. PMID 22151149.
- ^ Moody SC, Loveridge EJ (decembar 2014). "CYP105-diverse structures, functions and roles in an intriguing family of enzymes in Streptomyces". Journal of Applied Microbiology. 117 (6): 1549–1563. doi:10.1111/jam.12662. PMC 4265290. PMID 25294646.
- ^ Narhi LO, Fulco AJ (juni 1986). "Characterization of a catalytically self-sufficient 119,000-dalton cytochrome P-450 monooxygenase induced by barbiturates in Bacillus megaterium". The Journal of Biological Chemistry. 261 (16): 7160–7169. doi:10.1016/S0021-9258(17)38369-2. PMID 3086309.
- ^ Girvan HM, Waltham TN, Neeli R, Collins HF, McLean KJ, Scrutton NS, et al. (decembar 2006). "Flavocytochrome P450 BM3 and the origin of CYP102 fusion species". Biochemical Society Transactions. 34 (Pt 6): 1173–1177. doi:10.1042/BST0341173. PMID 17073779.
- ^ Wright RL, Harris K, Solow B, White RH, Kennelly PJ (april 1996). "Cloning of a potential cytochrome P450 from the archaeon Sulfolobus solfataricus". FEBS Letters. 384 (3): 235–239. doi:10.1016/0014-5793(96)00322-5. PMID 8617361. S2CID 19579406.
- ^ Vanden Bossche H, Marichal P, Gorrens J, Coene MC (septembar 1990). "Biochemical basis for the activity and selectivity of oral antifungal drugs". British Journal of Clinical Practice. Supplement. 71: 41–46. PMID 2091733.
- ^ a b Mizutani M (2012). "Impacts of diversification of cytochrome P450 on plant metabolism". Biological & Pharmaceutical Bulletin. 35 (6): 824–832. doi:10.1248/bpb.35.824. PMID 22687470.
- ^ Mizutani M, Sato F (mart 2011). "Unusual P450 reactions in plant secondary metabolism". Archives of Biochemistry and Biophysics. P450 Catalysis Mechanisms. 507 (1): 194–203. doi:10.1016/j.abb.2010.09.026. PMID 20920462.
- ^ Schuler MA, Werck-Reichhart D (1. 1. 2003). "Functional genomics of P450s". Annual Review of Plant Biology. 54 (1): 629–667. doi:10.1146/annurev.arplant.54.031902.134840. PMID 14503006.
- ^ Xu J, Wang X, Guo W (1. 9. 2015). "The cytochrome P450 superfamily: Key players in plant development and defense". Journal of Integrative Agriculture (jezik: engleski). 14 (9): 1673–1686. doi:10.1016/S2095-3119(14)60980-1. ISSN 2095-3119.
- ^ Heitz T, Widemann E, Lugan R, Miesch L, Ullmann P, Désaubry L, et al. (februar 2012). "Cytochromes P450 CYP94C1 and CYP94B3 catalyze two successive oxidation steps of plant hormone Jasmonoyl-isoleucine for catabolic turnover". The Journal of Biological Chemistry. 287 (9): 6296–6306. doi:10.1074/jbc.M111.316364. PMC 3307330. PMID 22215670.
- ^ Pandian BA, Sathishraj R, Djanaguiraman M, Prasad PV, Jugulam M (maj 2020). "Role of Cytochrome P450 Enzymes in Plant Stress Response". Antioxidants. 9 (5): 454. doi:10.3390/antiox9050454. PMC 7278705. PMID 32466087.
- ^ "Canvas Login". login.canvas.uw.edu. Arhivirano s originala, 7. 6. 2022. Pristupljeno 7. 6. 2022.
- ^ Chefson A, Auclair K (oktobar 2006). "Progress towards the easier use of P450 enzymes". Molecular BioSystems. 2 (10): 462–469. doi:10.1039/b607001a. PMID 17216026.
- ^ Chefson A, Zhao J, Auclair K (juni 2006). "Replacement of natural cofactors by selected hydrogen peroxide donors or organic peroxides results in improved activity for CYP3A4 and CYP2D6". ChemBioChem. 7 (6): 916–919. doi:10.1002/cbic.200600006. PMID 16671126. S2CID 39329433.
- ^ Chefson A, Auclair K (juli 2007). "CYP3A4 activity in the presence of organic cosolvents, ionic liquids, or water-immiscible organic solvents". ChemBioChem. 8 (10): 1189–1197. doi:10.1002/cbic.200700128. PMID 17526062. S2CID 11845235.
- ^ Petros WP, Younis IR, Ford JN, Weed SA (oktobar 2012). "Effects of tobacco smoking and nicotine on cancer treatment". Pharmacotherapy. 32 (10): 920–931. doi:10.1002/j.1875-9114.2012.01117. PMC 3499669. PMID 23033231.
Dopunska literatura
[uredi | uredi izvor]- Gelboin HV, Krausz K (mart 2006). "Monoclonal antibodies and multifunctional cytochrome P450: drug metabolism as paradigm". Journal of Clinical Pharmacology. 46 (3): 353–372. doi:10.1177/0091270005285200. PMID 16490812. S2CID 33325397.
- Gelboin HV, Krausz KW, Gonzalez FJ, Yang TJ (novembar 1999). "Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery". Trends in Pharmacological Sciences. 20 (11): 432–438. doi:10.1016/S0165-6147(99)01382-6. PMID 10542439.
- "Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies". home.ccr.cancer.gov. Arhivirano s originala, 30. 3. 2016. Pristupljeno 2. 4. 2018.
- Krausz KW, Goldfarb I, Buters JT, Yang TJ, Gonzalez FJ, Gelboin HV (novembar 2001). "Monoclonal antibodies specific and inhibitory to human cytochromes P450 2C8, 2C9, and 2C19". Drug Metabolism and Disposition. 29 (11): 1410–1423. PMID 11602516.
- Gonzalez FJ, Gelboin HV (1994). "Role of human cytochromes P450 in the metabolic activation of chemical carcinogens and toxins". Drug Metabolism Reviews. 26 (1–2): 165–183. doi:10.3109/03602539409029789. PMID 8082563.
- Estabrook RW (decembar 2003). "A passion for P450s (rememberances of the early history of research on cytochrome P450)". Drug Metabolism and Disposition. 31 (12): 1461–1473. doi:10.1124/dmd.31.12.1461. PMID 14625342. S2CID 43655270.
Vanjski linkovi
[uredi | uredi izvor]- Degtyarenko K (9. 1. 2009). "Directory of P450-containing Systems". International Centre for Genetic Engineering and Biotechnology. Arhivirano s originala, 16. 7. 2016. Pristupljeno 10. 2. 2009.
- Flockhart DA (4. 9. 2008). "Human Cytochrome P450 (CYP) Allele Nomenclature Committee". Karolinska Institutet. Pristupljeno 10. 2. 2009.
- Preissner S (2010). "Cytochrome P450 database". Nucleic Acids Research. Arhivirano s originala, 3. 11. 2011. Pristupljeno 23. 9. 2022.
- Sigaroudi A, Vollbrecht H (2019). "pharmacokinetic interaction table". Sigaroudi & Vollbrecht.
- Sim SC (2007). "Cytochrome P450 drug interaction table". Indiana University-Purdue University Indianapolis. Arhivirano s originala, 30. 8. 2007. Pristupljeno 10. 2. 2009.
- https://www.ted.com/talks/hartmut_neven_quantum_computers_aren_t_what_you_think_they_re_cooler/transcript?subtitle=en 9:15 Hartmut Neven govori kako kvantni računari pomažu u otkrivanju novih lijekova: "Konkretno, radili smo s jednom farmaceutskom kompanijom na algoritmima za opisivanje citokroma P450. Ova grupa enzima metabolizira oko 75 posto lijekova koje uzimamo."
