Ácido araquidónico
O ácido araquidónico (AA, ou ARA) é un ácido graxo poliinsaturado omega-6 de 20 átomos de carbono [2]. É o homólogo do ácido saturado ácido araquídico, que se encontra no aceite de cacahuete, (Arachis hypogaea), de onde lle vén o nome a ambos.[3] É líquido a temperatura ambiental normal, xa que o seu punto de fusión é de -49 °C.
| Ácido araquidónico | |
|---|---|
 | |

|

|
Ácido (5Z,8Z,11Z,14Z)-5,8,11,14-eicosatetraenoico | |
Ácido (5Z,8Z,11Z,14Z)-icosa-5,8,11,14-tetraenoico[1] | |
Outros nomes Ácido 5,8,11,14-all-cis-eicosatetraenoic; ácido todo-cis-5,8,11,14-eicosatetraenoico; araquidonato | |
| Identificadores | |
| Número CAS | 506-32-1 |
| PubChem | 444899 |
| ChemSpider | 392692 |
| UNII | 27YG812J1I |
| Número CE | 208-033-4 |
| DrugBank | DB04557 |
| KEGG | C00219 |
| MeSH | Arachidonic+acid |
| ChEBI | CHEBI:36306 |
| ChEMBL | CHEMBL15594 |
| Número RTECS | CE6675000 |
| Referencia Beilstein | 1713889 |
| 3DMet | B00061 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C20H32O2 |
| Masa molar | 304,47 g mol−1 |
| Densidade | 0,922 g/cm3 |
| Punto de fusión | -49 °C |
| Punto de ebulición | 169-171 °C (a 0,15 mmHg) |
| log P | 6,994 |
| Acidez (pKa) | 4,752 |
| Perigosidade | |
| Frases R | R19 |
| NFPA 704 | |
| Punto de inflamabilidade | 113 °C |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |



Química
editarEn canto á súa estrutura químca, o ácido araquidónico é un ácido carboxílico de 20 carbonos poliinsaturado con catro dobres enlaces situados nos carbonos 5, 8, 11 e 14, todos eles cis [4]. Como o primeiro dobre enlace está no sexto carbono empezando polo final da cadea, é un ácido graxo omega-6 ou n-6. Considérase un ácido graxo insaturado de cadea longa.
Nalgunhas fontes químicas utilízase o termo "ácido araquidónico" para designar a calquera dos ácidos eicosatetraenoicos. Pero, polo contrario, case todos as publicacións de bioloxía, medicina e nutrición limitan ese termo ao ácido todo-cis-5,8,11,14-eicosatetraenoico.
Bioloxía
editarO ácido araquidónico é un dos ácidos graxos poliinsaturados presente nos fosfolípidos (especialmente fosfatidiletanolamina, fosfatidilcolina, e nos fosfatidilinosítidos) das membranas celulares, e abunda no cerebro, músculos, e fígado.
Ademais de intervir na sinalización celular como un lípido segundo mensaxeiro implicado na regulación de encimas de sinalización, como a PLC-γ, PLC-δ, e PKC-α, -β, e -γ, o ácido araquidónico é tamén un intermediato inflamatorio fundamental e pode actuar como vasodilatador.[5] Véxanse as rutas biosintéticas de formación de eicosanoides, que se describen nunha sección máis abaixo.
Relación cos ácidos graxos esenciais
editar- Artigo principal: Ácido graxo esencial.
O ácido araquidónico non é un ácido graxo esencial, xa que se pode sintetizar a partir do ácido linoleico, que si é esencial. Aínda así, pode chegar a ser esencial para o organismo se hai deficiencia de ácido linoleico ou se non se ten a capacidade de converter o ácido linoleico en ácido araquidónico, que é requirido pola maioría dos mamíferos. Algúns mamíferos non teñen a capacidade (ou téñena moi limitada) de converter o ácido linoleico en ácido araquidónico, polo que para eles é un compoñente esencial da súa dieta. Como nas plantas comúns hai pouco ou ningún ácido araquidónico, ditos animais son carnívoros obrigados; sendo un exemplo o gato.[6][7] Porén, unha fonte comercial de ácido araquidónico é o fungo Mortierella alpina.[8]
Síntese e fervenza
editarO ácido araquidónico sintetízase a partir do ácido linoleico, que ten dous carbonos menos e dous dobres enlaces menos, polo que deben eliminarse varios hidróxenos e unha elongase debe engadir dous carbonos. O ácido araquidónico pasa a formar parte das moléculas de moitos fosfolípidos.
O ácido araquidónico é liberado das moléculas de fosfolípidos dos que forma parte polo encima fosfolipase A2 (PLA2), a cal escinde os ácidos graxos do fosfolípido, pero pode tamén xerarse na escisión dun diacilglicérido pola diacilglicerol lipase.[5]
O ácido araquidónico xerado como sinalizador celular parece derivar da acción da fosfolipase A2 citosólica específica da fosfatidilcolina (cPLA2, de 85 kDa), entanto que o ácido araquidónico con funcións inflamatorias xérase pola acción dunha PLA2 secretoria de baixo peso molecular (sPLA2, de 14-18 kDa).[5]
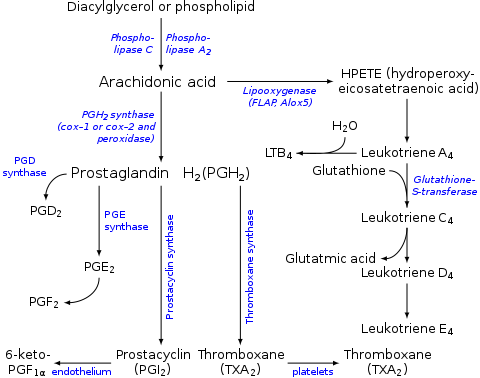
O ácido araquidónico é un precursor na produción de eicosanoides:
- Os encimas ciclooxixenase e peroxidase orixinan prostaglandina H2, a cal á súa vez se utiliza para producir as prostaglandinas, prostaciclinas, e tromboxanos.
- O encima 5-lipoxixenase orixina o 5-HPETE, o cal á súa vez se utiliza para producir os leucotrienos.
- O ácido araquidónico tamén intervén na biosíntese de anandamida.
- Algunhas moléculas de ácido araquidónico convértense en ácidos hidroxieicosatetraenoicos (HETEs) e ácidos epoxieicosatrienoicos (EETs) por acción da epoxixenase.[9]
A produción destes derivados e a súa acción no corpo coñécense en conxunto como a fervenza do ácido araquidónico, que é importante nas interaccións entre os ácidos graxos esenciais.
Activación da fosfolipase A2
editarA PLA2, é activada pola unión dun ligando a receptores, entre os que están:
- os receptores 5-HT2 [10]
- receptor 1 metabotrópico do glutamato (mGLUR1)[10]
- receptor do factor de crecemento dos fibroblastos básico (bFGF)[10]
- receptor do interferón-alfa[10]
- receptor do interferón-gamma[10]
Ademais, calquera axente que incremente o calcio intracelular pode causar a activación dalgunhas formas de PLA2.[11]
Activación da fosfolipase C
editarO ácido araquidónico pode ser tamén escindido dos fosfolípidos pola fosfolipase C (PLC), rendendo diacilglicéridos (DAG), que son seguidamente escindidos pola DAG lipase orixinando ácido araquidónico.[10]
Os receptores que activan esta vía metabólica son:
A PLC pode tamén ser activada pola MAP quinase. Entre os activadores desta vía están o factor de crecemento derivado das plaquetas (PDGF) e o factor de crecemento de fibroblastos (FGF).[11]
O ácido araquidónico no organismo
editarCerebro
editarO ácido araquidónico é un dos ácidos graxos máis abundantes no cerebro, e está presente en cantidades similares ás do ácido docosahexaenoico (DHA). Entre os dous supoñen aproximadamente o 20% do contido en ácidos graxos do cerebro.[12] Xunto co ácido docosahexaenoico, o ácido araquidónico é necesario para a saúde neurolóxica. O ácido araquidónico axuda a manter a fluidez das membranas celulares do hipocampo,[13] axuda a protexer o cerebro do estrés oxidativo activando o receptor activado polo proliferador do peroxisoma gamma [14], e activa a sintaxina-3 (STX-3), unha proteína implicada no crecemento e reparación das neuronas.[15]
Nos adultos a alteración do metabolismo do ácido araquidónico pode estar asociado a trastornos neurolóxicos como a enfermidade de Alzheimer e o trastorno bipolar,[16] nos que poden estar implicadas significativas alteracións na conversión do ácido araquidónico a outras moléculas bioactivas (sobreexpresión ou alteracións na cascada encimática do ácido araquidónico). Algúns estudos indican que o consumo de ácido araquidónico non está asociado co comezo do Alzheimer e que a suplementación nas fases iniciais podería ser beneficiosa,[17] aínda que son necesarios máis estudos.
Crecemento muscular
editarPor medio da súa conversiñon en compoñentes activos como a prostaglandina PGF2alfa, o ácido araquidónico é necesario para a reparación e crecemento do músculo esquelético.[18] Esta función fai do ácido araquidónico un compoñente dietario importante para axudar ao proceso anabólico do músculo.
O ácido araquidónico comercialízase como un suplemento que favorece o anabolismo muscular nos culturistas. Os estudos preliminares mostran unha mellora coa suplementación nas características musculares,[19] e unha redución no repouso dos niveis de IL-6 (un regulador central da inflamación). Pero son necesarios máis estudos.
Inflamación
editarNas condicións metabólicas normais, o incremento do consumo de ácido araquidónico na dieta é improbable que orixine un aumento da inflamación. O ácido araquidónico metabolízase orixinando tanto moléculas proinflamatorias coma antiinflamatorias.[20] Estudos nos que se daban entre 840 mg e 2.000 mg diarios a individuos sans durante 50 días non mostraron ningún incremento na inflamación ou actividades metabólicas relacionadas.[20][21][22][23] Un incremento dos niveis de ácido araquidónico está asociado con niveis reducidos das substancias proinflamatorias IL-6 e IL-1, e o incremento do antiinflamatorio factor beta da necrose tumoral.[24] Isto pode dar lugar a unha redución da inflamación sistémica.
O ácido araquidónico xoga un papel central na inflamación relacionada con feridas e moitas enfermidades. O modo en que sexa metabolizado no corpo determina a súa actividade inflamatoria ou antiinflamatoria. As persoas que sofren de dores articulares ou enfermidades inflamatorias activas poden ver exacerbados os síntomas ao incrementaren o consumo de ácido araquidónico, o que se cre que se debe a que é convertido máis rapidamente en compostos inflamatorios. Igualmente, non se aconsella un consumo elevado de ácido araquidónico a persoas que teñan un historial de enfermidades inflamatorias, ou que teñan problemas serios de saúde. Nas persoas sas a suplementación con ácido araquidónico non ten efectos proinflamatorios, pero podería contrarrestar os efectos antiinflamatorios dos ácidos omega-3.[25]
Efectos sobre a saúde da suplementación con ácido araquidónico
editarA suplementación con ácido araquidónico a doses de 1.000-1.500 mg diarias durante 50 días foi ben tolerada en varios estudos clínicos, sen que se informase de efectos secundarios significativos. Todos os indicadores de saúde, incluídos a función renal e hepática,[22] lípidos séricos,[26] inmunidade,[27] e agregación plaquetaria [21] non se viron afectados a esta dose e período de duración. Ademais, maiores concentracións de ácido araquidónico no tecido muscular poden estar correlacionadas cun aumento da sensibilidade á insulina.[28] A suplementación con ácido araquidónico nos adultos sans parece non ter toxicidade nin riscos significativos.
Un consello científico da American Heart Association evaluou positivamente o impacto na saúde da suplementación con graxas omega-6 da dieta, incluído o ácido araquidónico.[29] O ácido araquidónico da dieta non é un factor de risco para as enfermidacdes cardíacas, e pode ter un papel no mantemento do metabolismo óptimo e reducir os riscos de problemas cardíacos. Recomendan manter un consumo suficiente de ácidos graxos esenciais omega-3 e omega-6 para ter unha boa saúde.
O ácido araquidónico non é canceríxeno, e os estudos mostran que os niveis consumidos na dieta non están asociados cun incremento no risco do cancro.[30][31][32][33] Porén, o ácido araquidónico é un metabolito central nos procesos inflamatorios e de crecemento celular, os cales se ven alterados en moitos tipos de enfermidades, incluíndo o cáncer. Por tanto, a seguridade da suplementación con ácido araquidónico en pacientes de cáncer, enfermidades inflamatorias, ou outras doenzas non se coñece, polo que nestes casos a suplementación non se recomenda.
Notas
editar- ↑ http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=231
- ↑ PubChem compound Arachidonic acid
- ↑ "Dorland's Medical Dictionary – 'A'". Consultado o 2007-01-12.
- ↑ ChemSpider Arachidonic acid
- ↑ 5,0 5,1 5,2 Baynes John W., Marek H. Dominiczak (2005). Elsevier Mosby, ed. Medical Biochemistry 2nd. Edition. p. 555. ISBN 0723433410.
- ↑ MacDonald, ML; Rogers, QR; Morris, JG (1984). "Nutrition of the Domestic Cat, a Mammalian Carnivore". Annual Review of Nutrition 4: 521–62. PMID 6380542. doi:10.1146/annurev.nu.04.070184.002513.
- ↑ Rivers, JP; Sinclair, AJ; Craqford, MA (1975). "Inability of the cat to desaturate essential fatty acids". Nature 258 (5531): 171–3. Bibcode:1975Natur.258..171R. PMID 1186900. doi:10.1038/258171a0.
- ↑ History of Martek, Martek.com
- ↑ Walter F., PhD. Boron (2003). Elsevier/Saunders, ed. Medical Physiology: A Cellular And Molecular Approaoch. p. 108. ISBN 1-4160-2328-3.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Walter F., PhD. Boron (2003). Elsevier/Saunders, ed. Medical Physiology: A Cellular And Molecular Approaoch. p. 103. ISBN 1-4160-2328-3.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 Walter F., PhD. Boron (2003). Elsevier/Saunders, ed. Medical Physiology: A Cellular And Molecular Approaoch. p. 104. ISBN 1-4160-2328-3.
- ↑ Crawford, MA; Sinclair, AJ (1971). "Nutritional influences in the evolution of mammalian brain. In: lipids, malnutrition & the developing brain". Ciba Foundation symposium: 267–92. PMID 4949878.
- ↑ Fukaya, T.; Gondaira, T.; Kashiyae, Y.; Kotani, S.; Ishikura, Y.; Fujikawa, S.; Kiso, Y.; Sakakibara, M. (2007). "Arachidonic acid preserves hippocampal neuron membrane fluidity in senescent rats". Neurobiology of aging 28 (8): 1179–1186. doi:10.1016/j.neurobiolaging.2006.05.023. PMID 16790296.
- ↑ Wang, ZJ; Liang, CL; Li, GM; Yu, CY; Yin, M (2006). "Neuroprotective effects of arachidonic acid against oxidative stress on rat hippocampal slices". Chemico-biological interactions 163 (3): 207–17. PMID 16982041. doi:10.1016/j.cbi.2006.08.005.
- ↑ Darios, F; Davletov, B (2006). "Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3.". Nature 440 (7085): 813–7. Bibcode:2006Natur.440..813D. PMID 16598260. doi:10.1038/nature04598.
- ↑ Rapoport, SI (2008). "Arachidonic acid and the brain". The Journal of nutrition 138 (12): 2515–20. PMID 19022981.
- ↑ Schaeffer, EL; Forlenza, OV; Gattaz, WF (2009). "Phospholipase A2 activation as a therapeutic approach for cognitive enhancement in early-stage Alzheimer disease". Psychopharmacology 202 (1–3): 37–51. PMID 18853146. doi:10.1007/s00213-008-1351-0.
- ↑ Trappe, TA; Fluckey, JD; White, F; Lambert, CP; Evans, WJ (2001). "Skeletal muscle PGF(2)(alpha) and PGE(2) in response to eccentric resistance exercise: influence of ibuprofen acetaminophen.". The Journal of clinical endocrinology and metabolism 86 (10): 5067–70. PMID 11600586. doi:10.1210/jc.86.10.5067.
- ↑ Roberts, MD; Iosia, M; Kerksick, CM; Taylor, LW; Campbell, B; Wilborn, CD; Harvey, T; Cooke, M; Rasmussen, C (2007). "Effects of arachidonic acid supplementation on training adaptations in resistance-trained males". Journal of the International Society of Sports Nutrition 4: 21. PMC 2217562. PMID 18045476. doi:10.1186/1550-2783-4-21.
- ↑ 20,0 20,1 Harris, WS; Mozaffarian, D; Rimm, E; Kris-Etherton, P; Rudel, LL; Appel, LJ; Engler, MM; Engler, MB; Sacks, F (2009). "Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention". Circulation 119 (6): 902–7. PMID 19171857. doi:10.1161/CIRCULATIONAHA.108.191627.
- ↑ 21,0 21,1 Nelson, GJ; Schmidt, PC; Bartolini, G; Kelley, DS; Kyle, D (1997). "The effect of dietary arachidonic acid on platelet function, platelet fatty acid composition, and blood coagulation in humans". Lipids 32 (4): 421–5. PMID 9113631. doi:10.1007/s11745-997-0055-7.
- ↑ 22,0 22,1 Changes in whole blood and clinical safety markers over 50 days of concomitant arachidonic acid supplementation and resistance training. Wilborn, C, M Roberts, C Kerksick, M Iosia, L Taylor, B Campbell, T Harvey, R Wilson, M. Greenwood, D Willoughby and R Kreider. Proceedings of the International Society of Sports Nutrition (ISSN) Conference June 15–17, 2006. http://arachidonic.com/ARA-baylorsafety.pdf Arquivado 07 de xullo de 2011 en Wayback Machine.
- ↑ Pantaleo, P; Marra, F; Vizzutti, F; Spadoni, S; Ciabattoni, G; Galli, C; La Villa, G; Gentilini, P; Laffi, G (2004). "Effects of dietary supplementation with arachidonic acid on platelet and renal function in patients with cirrhosis". Clinical science 106 (1): 27–34. PMID 12877651. doi:10.1042/CS20030182.
- ↑ Ferrucci, L; Cherubini, A; Bandinelli, S; Bartali, B; Corsi, A; Lauretani, F; Martin, A; Andres-Lacueva, C; Senin, U (2006). "Relationship of plasma polyunsaturated fatty acids to circulating inflammatory markers". The Journal of clinical endocrinology and metabolism 91 (2): 439–46. PMID 16234304. doi:10.1210/jc.2005-1303.
- ↑ Li, B; Birdwell, C; Whelan, J (1994). "Antithetic relationship of dietary arachidonic acid and eicosapentaenoic acid on eicosanoid production in vivo". Journal of lipid research 35 (10): 1869–77. PMID 7852864.
- ↑ Nelson, GJ; Schmidt, PC; Bartolini, G; Kelley, DS; Phinney, SD; Kyle, D; Silbermann, S; Schaefer, EJ (1997). "The effect of dietary arachidonic acid on plasma lipoprotein distributions, apoproteins, blood lipid levels, and tissue fatty acid composition in humans". Lipids 32 (4): 427–33. PMID 9113632. doi:10.1007/s11745-997-0056-6.
- ↑ Kelley, DS; Taylor, PC; Nelson, GJ; MacKey, BE (1998). "Arachidonic acid supplementation enhances synthesis of eicosanoids without suppressing immune functions in young healthy men". Lipids 33 (2): 125–30. PMID 9507233. doi:10.1007/s11745-998-0187-9.
- ↑ Borkman, M; Storlien, LH; Pan, DA; Jenkins, AB; Chisholm, DJ; Campbell, LV (1993). "The relation between insulin sensitivity and the fatty-acid composition of skeletal-muscle phospholipids". The New England journal of medicine 328 (4): 238–44. PMID 8418404. doi:10.1056/NEJM199301283280404.
- ↑ Harris, WS; Mozaffarian, D; Rimm, E; Kris-Etherton, P; Rudel, LL; Appel, LJ; Engler, MM; Engler, MB; Sacks, F (2009). "Omega-6 Fatty Acids and Risk for Cardiovascular Disease: A Science Advisory From the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention". Circulation 119 (6): 902–7. PMID 19171857. doi:10.1161/CIRCULATIONAHA.108.191627.
- ↑ Schuurman, AG; Van Den Brandt, PA; Dorant, E; Brants, HA; Goldbohm, RA (1999). "Association of energy and fat intake with prostate carcinoma risk: results from The Netherlands Cohort Study". Cancer 86 (6): 1019–27. PMID 10491529. doi:10.1002/(SICI)1097-0142(19990915)86:6<1019::AID-CNCR18>3.0.CO;2-H.
- ↑ Leitzmann, MF; Stampfer, MJ; Michaud, DS; Augustsson, K; Colditz, GC; Willett, WC; Giovannucci, EL (2004). "Dietary intake of n-3 and n-6 fatty acids and the risk of prostate cancer". The American journal of clinical nutrition 80 (1): 204–16. PMID 15213050.
- ↑ Astorg, P (2005). "Dietary fatty acids and colorectal and prostate cancers: epidemiological studies". Bulletin du cancer 92 (7): 670–84. PMID 16123006.
- ↑ Whelan, J; McEntee, MF (2004). "Dietary (n-6) PUFA and intestinal tumorigenesis". The Journal of nutrition 134 (12 Suppl): 3421S–3426S. PMID 15570048.
Véxase tamén
editarOutros artigos
editar- Eicosanoides
- Ácidos graxos poliinsaturados
- Aspirina. Inhibe o encima ciclooxixenase e impide a formación de eicosanoides a partir do ácido araquidónico.
Ligazóns externas
editar- Arachidonic Acid en acnp.org
