Butanón

Butanón, tiež známy ako metyletylketón (MEK),a je organická zlúčenina so vzorcom CH3C(O)CH2CH3. Tento bezfarebný tekutý ketón má ostrý, sladký zápach pripomínajúci acetón. Priemyselne sa vyrába vo veľkom, no v prírode sa vyskytuje len v stopových množstvách.[1] Je čiastočne rozpustný vo vode a bežne sa používa ako priemyselné rozpúšťadlo.[2] Butanón je izomérom iného rozpúšťadla, tetrahydrofuránu.
Výroba
[upraviť | upraviť zdroj]Butanonyl sa môže vyrábať oxidáciou 2-butanolu. Dehydrogenácia 2-butanolu je katalyzovaná meďou, zinkom alebo bronzom:
Ročne sa z neho vyrobí približne 700 miliónov kilogramov. Medzi ďalšie syntézy, ktoré boli preskúmané, ale neimplementované, patrí Wackerova oxidácia 2-buténu a oxidácia izobutylbenzénu, ktorá je analogická s priemyselnou výrobou acetónu.[1] Kuménov proces je možno modifikovať tak, aby sa vyrábal fenol a zmes acetónu a butanónu namiesto iba fenolu a acetónu v origináli.[3]
Oxidácia ťažkého benzínu v kvapalnej fáze Fischerou-Tropschovou reakciou vytvárajú zmiešané pary oxygenátov, z ktorých sa frakcionáciou extrahuje 2-butanón.[4]
Aplikácie
[upraviť | upraviť zdroj]Ako rozpúšťadlo
[upraviť | upraviť zdroj]Butanón je účinné a bežné rozpúšťadlo[2] a používa sa v procesoch zahŕňajúcich gumy, živice, acetát celulózy a nitrocelulózové povlaky a vo vinylových filmoch.[5] Z tohto dôvodu nachádza využitie pri výrobe plastov, textílií, pri výrobe parafínového vosku a vo výrobkoch pre domácnosť ako laky, laky, odstraňovače farieb, denaturačný prostriedok na denaturovaný lieh, lepidlá a ako čistiaci prostriedok. Má podobné rozpúšťadlové vlastnosti ako acetón, ale vrie pri vyššej teplote a má výrazne nižšiu rýchlosť odparovania.[6] Butanón na rozdiel od acetónu tvorí s vodou azeotropickú zmes,[7][8] čo ho robí užitočným na azeotropickú destiláciu vlhkosti v určitých aplikáciách. Používa sa tiež vo stierateľných popisovačov na biele tabule ako rozpúšťadlo farbiva.
Ako prostriedok na zváranie plastov
[upraviť | upraviť zdroj]Keďže butanón rozpúšťa polystyrén a mnohé ďalšie plasty, predáva sa ako „modelársky cement“ na použitie pri spájaní častí zostáv zmenšených modelov. Hoci sa často považuje za lepidlo, v tomto kontexte funguje ako zváracie činidlo.
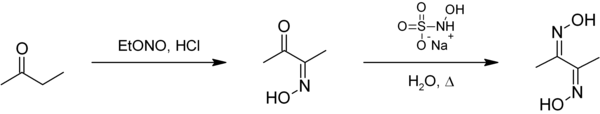
Butanón je prekurzorom metyletylketónperoxidu, ktorý je katalyzátorom niektorých polymerizačných reakcií, ako je zosieťovanie nenasýtených polyesterových živíc. Dimetylglyoxím je možné pripraviť z butanónu najprv reakciou s etylnitritom za vzniku diacetylmonoxímu a následnou konverziou na dioxím:[9]
V peroxidovom procese pri výrobe hydrazínu sa východiskový chemický amoniak viaže na butanón, oxiduje sa peroxidom vodíka a viaže sa na inú molekulu amoniaku.
V poslednom kroku procesu hydrolýza produkuje požadovaný produkt, hydrazín, a regeneruje butanón.
Bezpečnosť
[upraviť | upraviť zdroj]Horľavosť
[upraviť | upraviť zdroj]Butanón môže reagovať s väčšinou oxidačných materiálov a môže spôsobiť požiar.[2] Je stredne výbušný a vyžaduje len malý plameň alebo iskru na vyvolanie prudkej reakcie.[2] Para je ťažšia ako vzduch, takže sa môže hromadiť v nízkych bodoch. Je výbušný v koncentráciách medzi 1,4 a 11,4 %.[10] Koncentrácie vo vzduchu dostatočne vysoké na to, aby boli horľavé, sú pre ľudí netolerovateľné kvôli dráždivému charakteru výparov.[6] Požiar butanónu by sa mal hasiť oxidom uhličitým, suchými prostriedkami alebo penou odolnou voči alkoholu.[2]
Účinky na zdravie
[upraviť | upraviť zdroj]Butanón je zložkou tabakového dymu.[11] Je dráždivý, spôsobuje podráždenie očí a nosa u ľudí.[6] Vážne účinky na zdravie zvierat boli pozorované len vo veľmi vysokých úrovniach. Neexistujú žiadne dlhodobé štúdie so zvieratami, ktoré ho dýchajú alebo pijú, a žiadne štúdie karcinogenity u zvierat, ktoré ho dýchajú alebo pijú. Existujú určité dôkazy, že butanón môže zosilniť toxicitu iných rozpúšťadiel, na rozdiel od výpočtu expozícií zmiešaných rozpúšťadiel jednoduchým sčítaním expozícií.[12]
Od roku 2010 Agentúra pre ochranu životného prostredia Spojených štátov (EPA) zaradila butanón medzi toxické chemikálie. Existujú správy o neuropsychologických účinkoch. Rýchlo sa vstrebáva cez nepoškodenú kožu a pľúca. Prispieva k tvorbe prízemného ozónu, ktorý je v nízkych koncentráciách toxický.[10]
Butanón je uvedený ako prekurzor v tabuľke II podľa Dohovoru Organizácie Spojených národov proti nezákonnému obchodovaniu s omamnými a psychotropnými látkami.[13]
Nariadenia
[upraviť | upraviť zdroj]Emisie butanónu boli v USA regulované ako nebezpečná látka znečisťujúca ovzdušie, pretože ide o prchavú organickú zlúčeninu, ktorá prispieva k tvorbe troposférického (prízemného) ozónu. V roku 2005 Agentúra na ochranu životného prostredia USA odstránila butanón zo zoznamu nebezpečných látok znečisťujúcich ovzdušie (HAP).[14][15][16]
Pozri aj
[upraviť | upraviť zdroj]Poznámky
[upraviť | upraviť zdroj]^a - Medzinárodná skupina pre štandardy IUPAC zavrhla termín metyletylketón a teraz namiesto neho odporúča používať etylmetylketón.
Referencie
[upraviť | upraviť zdroj]- ↑ a b NEIER, Wilhelm; STREHLKE, Guenter. 2-Butanone. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a04_475 (po anglicky)
- ↑ a b c d e TURNER, Charles F; MACCREERY, Joseph W. The chemistry of fire and hazardous materials: Charles F. Turner and Joseph W. M[a]c Creery. Boston [usw.] : Allyn & Bacon, 1981. ISBN 978-0-205-06912-5. (po anglicky)
- ↑ NEIER, Wilhelm; STREHLKE, Guenter. 2-Butanone. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a04_475 (po anglicky)
- ↑ ASHFORD, Robert D. Ashford's Dictionary of industrial chemicals. 3. vyd. Saltash, UK : Wavelength, 2011. ISBN 978-0-9522674-3-0. S. 6013-6014. (po anglicky)
- ↑ APPS, E. A.. Printing ink technology. [s.l.] : London, L. Hill, 1958. Dostupné online. (po anglicky)
- ↑ a b c LONG, James E. Industrial toxicology (Fairhall, Lawrence T.). Journal of Chemical Education, 1970-08, roč. 47, čís. 8, s. A532. Dostupné online [cit. 2023-08-20]. ISSN 0021-9584. DOI: 10.1021/ed047pA532.1. (po anglicky)
- ↑ LANGE, Norbert Adolph. Lange's Handbook of Chemistry. Rev. 10th ed.. Journal of Pharmaceutical Sciences, 1968-02, roč. 57, čís. 2, s. 1496-1505. ISSN 0022-3549. DOI: 10.1002/jps.2600570238. (po anglicky)
- ↑ CRC Handbook of Chemistry and Physics, 44th ed. pp 2143-2184
- ↑ SEMON, W. L; DAMERELL, V. R. Dimethylglyoxime [online]. Organic Syntheses, 1943, [cit. 2023-08-20]. Dostupné online. (po anglicky)
- ↑ a b THOMPSON, Simon B. N. Implications For Cognitive Rehabilitation and Brain Injury From Exposure to Methyl Ethyl Ketone (MEK): A Review [online]. Journal of Cognitive Rehabilitation, Zima 2010, [cit. 2023-08-20]. S. 4–14. Dostupné online. Archivované 2022-01-21 z originálu. (po anglicky)
- ↑ LEE, Chiyoung; YI, Jee-Seon. Socioeconomic Classes among Oldest-Old Women in South Korea: A Latent Class Analysis. International Journal of Environmental Research and Public Health, 2021-12-14, roč. 18, čís. 24, s. 13183. ISSN 1660-4601. DOI: 10.3390/ijerph182413183. (po anglicky)
- ↑ DICK, F. D. Solvent neurotoxicity. Occupational and Environmental Medicine, 2006-03-01, roč. 63, čís. 3, s. 221–226. ISSN 1351-0711. DOI: 10.1136/oem.2005.022400. PMC: 2078137. (po anglicky)
- ↑ List of Precursors and Chemicals Frequently Used in the Illicit Manufacture of Narcotic Drugs and Psychotropic Substances Under International Control [online]. web.archive.org, [cit. 2023-08-20]. Dostupné online. Archivované 2008-02-27 z originálu. (po anglicky)
- ↑ Federal Register, Volume 70 Issue 242 (Monday, December 19, 2005) [online]. www.govinfo.gov, [cit. 2023-08-20]. Dostupné online.
- ↑ KANEGSBERG, Barbara. MEK No Longer a HAP [online]. Bfksolutions newsletter, 2015-04-02, [cit. 2023-08-20]. Dostupné online. Archivované 2015-04-21 z originálu. (po anglicky)
- ↑ EPA "De-Lists" MEK from CAA HAP List | PCI Magazine [online]. www.pcimag.com, [cit. 2023-08-20]. Dostupné online. (po anglicky)
Externé odkazy
[upraviť | upraviť zdroj]- Medzinárodná karta chemickej bezpečnosti 0179
- Národný zoznam znečisťujúcich látok: Prehľad metyletylketónov
- Vreckový sprievodca NIOSH k chemickým rizikám
- Údajový list US EPA
- Butanón v Consumer Product Information Database
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Butanone na anglickej Wikipédii.