Helix-draai-helix
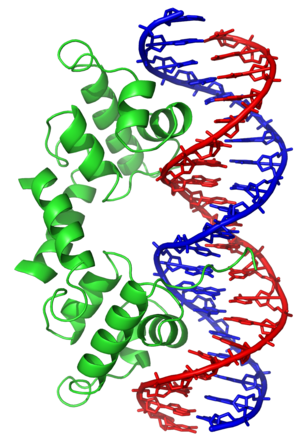
Het helix-draai-helix of HTH (Engels: helix-turn-helix) is een supersecundaire structuur dat uit drie segmenten bestaat. Het vormt een bestanddeel van DNA-bindende eiwitten met een sequentiespecifiek DNA-bindingsdomein en bestaat uit twee α-helices, die door een β-draai verbonden zijn. De ene bezet het N-terminale begin van het motief, de andere de C-terminus. Transcriptieregulatoren in bacteriën bevatten vaak een HTH-motief. Dit eiwit behoort tot de homeobox-domeinen.
Een helix bindt als herkenningshelix sequentiespecifiek in de grote groeve van het DNA en gaat een aantal intermoleculaire interacties aan, zoals waterstofbruggen en vanderwaalskrachten tussen aminozuren en de basen van het DNA, terwijl de andere helix een rechte hoek vormt, waardoor een labiele binding met het DNA gevormd wordt. Zo'n verbinding geeft enerzijds stabiliteit aan het eiwit-DNA-complex en anderzijds wordt de specificiteit van de reactie verhoogd, aangezien beide bindingspartners een zeer specifieke ruimtelijke structuur moeten vormen.
Dergelijke DNA-bindende eiwitten zijn homo-dimeren of tetrameren met een spiegelbeeldsymmetrische ordening van de DNA-bindingsdomeinen. Tussen de centra van de bindingsdomeinen zit een afstand van 34 Å. Deze afstand komt overeen met een draai van het DNA, zodat de beide herkenningssequenties in twee op elkaar volgende groeven van het DNA passen. De bindingssequenties zijn palindromen, opgebouwd uit twee omgekeerd geordende sequenties op een afstand van 11 basenparen van elkaar, die eveneens overeenkomen met een draai van het DNA. Daardoor liggen de beide herkenningssequenties precies in op elkaar volgende groeven van het DNA en worden zo door de beide herkenningshelices van een dimeer eiwit herkend.