Diossido di iridio
| Diossido di iridio | |
|---|---|
 | |
| Nomi alternativi | |
| ossido di iridio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | IrO2 |
| Massa molecolare (u) | 224,22 |
| Aspetto | solido nero inodore |
| Numero CAS | |
| Numero EINECS | 234-743-9 |
| PubChem | 82821 |
| SMILES | O=[Ir]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 11,66 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 1100 °C (1373 K) dec |
| Sistema cristallino | tetragonale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 272 - 315 - 319 [1] |
| Consigli P | 210 - 280 - 302+352 - 305+351+338 - 312 |
Il diossido di iridio o ossido di iridio(IV) è il composto chimico con formula IrO2. È l'unico ossido di iridio ben caratterizzato. In condizioni standard la sostanza pura è un solido nero insolubile e inodore. Esiste anche in forma idrata, IrO2•2H2O, un solido marrone, leggermente solubile in acqua.
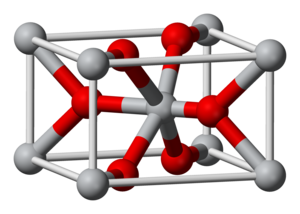
Struttura
[modifica | modifica wikitesto]IrO2 cristallizza nel sistema cristallino tetragonale nel gruppo spaziale P42/mnm con parametri di reticolo a = 449,83 pm e c = 354,4 pm; la cella elementare contiene due unità di formula. La struttura corrisponde a quella del rutilo.[2]
Sintesi
[modifica | modifica wikitesto]IrO2 si forma scaldando oltre 600 °C iridio elementare in presenza di ossigeno.
- Ir + O2 → IrO2
In condizioni più blande si può preparare per idrolisi di [IrCl6]2– in soluzione basica. IrO2 puro privo di cloro può essere preparato partendo da IrCl3•xH2O. Per idrolisi basica a temperatura ambiente si ottiene un idrossido idrato, che dopo calcinazione a 900 °C fornisce IrO2 cristallino.[3]
Reattività
[modifica | modifica wikitesto]IrO2 è un ossido stabile, ma si decompone di sopra di 1100 °C:[4]
- IrO2 → Ir + O2
Per riscaldamento di IrO2 assieme a ossidi o carbonati di altri metalli si ottengono ossidi misti. Ad esempio, con Bi2O3 si forma Bi2Ir2O7, con CaCO3 si formano CaIrO3 e Ca2Ir2O4.[5]
Usi
[modifica | modifica wikitesto]IrO2 è usato per costruire anodi, sensori di pH e film sottili per materiali elettrocromici.[6]
Sicurezza
[modifica | modifica wikitesto]IrO2 può essere irritante per la pelle e gli occhi. Vanno usate le normali precauzioni dovute a tutti i prodotti chimici.
Note
[modifica | modifica wikitesto]- ^ ThermoFisher; rev. del 22/01/2021
- ^ J. D'Ans, E. Lax, Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3, 4ª ed., Springer, 1997, p. 496, ISBN 978-3-540-60035-0.
- ^ N. Bestaoui, E. Prouzet, A chimie douce route to pure iridium oxide, in Chem. Mater., vol. 9, n. 4, 1997, pp. 1036-1041, DOI:10.1021/cm9606282. URL consultato il 5 aprile 2011.
- ^ S. A. Cotton, Chemistry of the precious metals, Londra, Chapman & Hall, 1997, ISBN 0-7514-0413-6.
- ^ C. E. Housecroft, Iridium: inorganic & coordination chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2005, DOI:10.1002/0470862106.ia101, ISBN 978-0-470-86210-0.
- ^ C. M. Giandomenico, Platinum-group metals, compounds, in Kirk-Othmer Encyclopedia of chemical technology, 4ª ed., Wiley Interscience, 1998.
Bibliografia
[modifica | modifica wikitesto]- C. E. Housecroft, A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- N. N. Greenwood, A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
| Controllo di autorità | LCCN (EN) sh2013000128 · J9U (EN, HE) 987007600082605171 |
|---|