Acide malique
| Acide malique | |
  Structure de l'acide L-malique (à gauche) et de l'acide D-malique (à droite) : image spéculaire des deux énantiomères. |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2-hydroxybutanedioïque |
| Synonymes |
acide α-hydroxysuccinique |
| No CAS | (RS) D ou R(+) |
| No ECHA | 100.027.293 |
| No CE | 210-514-9 (DL) |
| PubChem | 525 |
| ChEBI | 6650 |
| No E | E296 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H6O5 [Isomères] |
| Masse molaire[1] | 134,087 4 ± 0,005 1 g/mol C 35,83 %, H 4,51 %, O 59,66 %, |
| pKa | 3,46 et 5,10[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 131 à 132 °C[2] |
| T° ébullition | 140 °C[2] (décomposition) |
| Solubilité | 558 g L−1[2] à 20 °C |
| Masse volumique | 1,60 g cm−3[2] à 20 °C |
| T° d'auto-inflammation | 349 °C[2] |
| Point d’éclair | 203 °C[2] |
| Thermochimie | |
| Cp | |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Cc[4] |
| Paramètres de maille | a = 13,053 Å b = 8,724 Å |
| Volume | 540,56 Å3[4] |
| Précautions | |
| SGH[2] | |
| H319, P280, P305+P351+P338 et P337+P313 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide malique est un acide dicarboxylique alpha-hydroxylé de formule HOOC-CH2-CHOH-COOH. Il existe sous la forme de deux diastéréoisomères, les énantiomères L et D ; seul l'acide L-malique est présent dans le milieu naturel. La base conjuguée de l'acide malique et ses sels sont appelés malates. L'anion L-malate est un intermédiaire du cycle de Krebs, l'une des voies métaboliques majeures de respiration cellulaire chez presque tous les êtres vivants, et intervient dans le cycle de Calvin, qui entre dans le cadre de la photosynthèse. L'acide L-malique est très répandu dans le règne végétal et naturellement présent dans les pommes, les poires et le jus de raisin, dont il contribue à la saveur agréable. Il est de ce fait utilisé comme additif alimentaire, sous le numéro E296.
Biochimie
[modifier | modifier le code]Le L-malate joue un rôle important en biochimie comme intermédiaire participant à plusieurs réactions structurantes du métabolisme cellulaire. Dans la fixation du carbone en C4, le L-malate est une source de CO2 dans le cycle de Calvin. Dans le cycle de Krebs, le L-malate est formé à partir de fumarate sous l'action de la fumarase. Il peut également être formé par des réactions anaplérotiques à partir du pyruvate.
Le L-malate est également produit par carboxylation du phosphoénolpyruvate dans les feuilles des plantes. La charge négative des anions L-malate est compensée de façon privilégiée par celles des cations potassium K+ lors de l'absorption des solutés par les cellules stomatiques des feuilles, ce qui préserve l'électroneutralité globale de la solution d'électrolytes présente dans le cytosol à l'intérieur des cellules. L'accumulation de ces solutés dans les cellules stomatiques fait chuter la concentration en solutés dans l'eau environnante, ce qui permet d'assurer son absorption par les cellules des feuilles en déclenchant l'ouverture des stomates.
Découverte et importance agroalimentaire
[modifier | modifier le code]L'acide L-malique a été isolé pour la première fois à partir de jus de pommes immatures par le chimiste poméranien Carl Wilhelm Scheele en 1785 qui le nomme « äpplesyra » (« acide des pommes »). C′est Antoine Lavoisier qui, en 1787, a proposé le nom d’acide malique à partir du latin malum[5],[6]. L'acide L-malique contribue à l'acidité des fruits verts. Il est présent dans le raisin et dans la plupart des vins à des concentrations pouvant parfois atteindre 5 g/L. Il donne un goût acidulé au vin, bien que la quantité présente décroisse au cours de la maturation des fruits. Le goût de l'acide malique est très clairement perceptible dans la rhubarbe, dont il constitue la saveur principale. La fermentation malolactique, utilisée en vinification, convertit l'acide malique en acide lactique, bien plus doux.
Production et principales réactions
[modifier | modifier le code]L'acide malique racémique est obtenu industriellement par double hydratation d'anhydride maléique. Les deux énantiomères peuvent être séparés par résolution chirale du racémique, tandis que l'énantiomère L peut être spécifiquement obtenu par fermentation de l'acide fumarique.
L'autocondensation (en) de l'acide malique par chauffage en présence d'un oléum (acide sulfurique fumant) conduit à l'acide coumalique[7], une pyrone :
-
(en) Conversion de l'acide malique en acide coumalique.
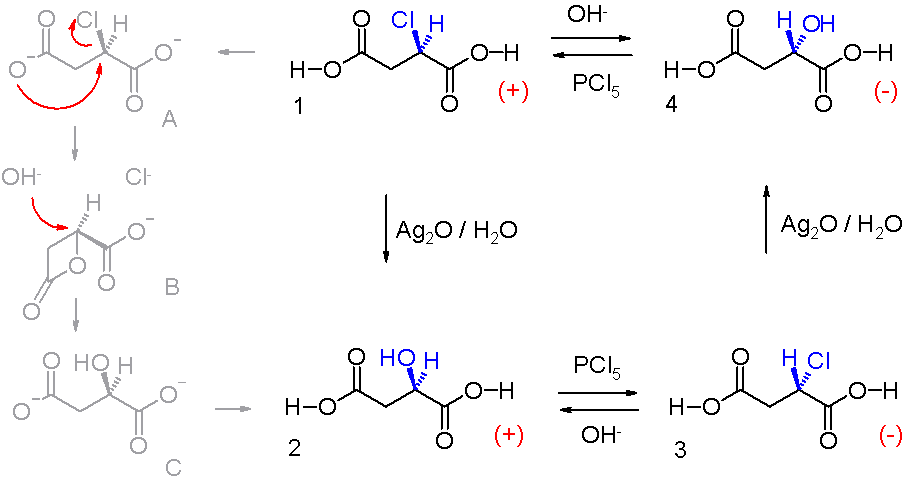
L'acide malique a joué un rôle important dans la découverte de l'inversion de Walden et du cycle de Walden, dans lequel l'acide L-malique est d'abord converti en acide chlorosuccinique sous l'action de pentachlorure de phosphore PCl5, puis en acide D-malique par oxyde d'argent(I) AgO2 aqueux. L'acide D-malique réagit avec le PCl5 pour redonner de l'acide chlorosuccinique, qui redonne l'acide L-malique sous l'action de l'AgO2 aqueux.
Fermentation malolactique en œnologie
[modifier | modifier le code]En plus de la fermentation alcoolique, une autre transformation microbiologique est indispensable à la production de certains vins de qualité, en particulier des vins rouges ; il s'agit de la fermentation lactique de l'acide malique par certaines bactéries, ou fermentation malolactique. Cette transformation abaisse l'acidité et assouplit les vins. Elle se produit le plus souvent immédiatement après la fermentation alcoolique, et permet de réaliser rapidement la stabilisation biologique du vin.
Après la fermentation principale, lorsque les sucres ont disparu, l’acide malique L (isomère gauche) restant est le principal facteur d’instabilité car il peut être fermenté par les bactéries. C’est pour cette raison qu’on cherche à provoquer cette fermentation avant la commercialisation du vin. Cette opération n’est toutefois pas utilisée partout de façon volontaire. En effet, effectuée sur un vin ayant une acidité normale, elle serait nuisible au bouquet. D’autre part, le vigneron doit faire attention à ce que cette fermentation ne fasse pas naître dans le vin une saveur d’acide lactique qui serait perceptible lors de la dégustation.
L’acide malique est étroitement apparenté à l’acide oxalique, mais possède un groupe –CH2-CH(OH)– entre les deux groupes d’acide carboxylique (caractère piquant de la pomme). Cette molécule possède deux énantiomères L et D, images l’une de l’autre dans un miroir. L’isomère L représente la forme la plus courante dans la nature.
L'acide malique contribue donc à définir l’état de maturité du raisin et même, dans une large mesure, la qualité du vin. Il est responsable de la sensation de vin non arrivé à maturité lorsque le raisin a subi un été frais, ainsi que du caractère un peu abrupt au goût des vins jeunes[8]. Depuis le raisin vert jusqu’au vin vineux, par les étapes de la maturation et des fermentations alcoolique et malolactique, la teneur en acide malique subit une série de diminutions, qui l’amène jusqu’à zéro ou presque, dans les vins non sulfités.
Phytoremédiation
[modifier | modifier le code]En phytoremédiation, on a découvert que pour le blé, du malate est émis par les cellules des extrémités des racines quand de l'aluminium dans le sol active une protéine de membrane encodée par ALMT1 (ce gène est le premier découvert dans une espèce végétale qui remplisse cette fonction d'adaptation à l'aluminium, et aussi le premier gène découvert encodant un type entièrement nouveau de protéine de transport). Les ions aluminium chargés positivement et les ions malate chargés négativement se lient et l'aluminium est ainsi neutralisé ce qui empêche les dégâts pour les racines.
Détartrant alimentaire
[modifier | modifier le code]Associé à l'acide citrique, l'acide malique est utilisé comme détartrant pour les cafetières et bouilloires. Il est efficace contre le tartre et contre les dépôts gras laissés par le café qui, mêlés au tartre, facilitent le développement d'une microflore au goût désagréable et facilitent l'oxydation des pièces métalliques qui diffusent alors aussi dans les boissons des ions métalliques altérant également le goût et dégradant les arômes. Il a également une action antibactérienne. Il est utilisable aussi pour redonner leur transparence aux verres et leur brillant aux couverts et ustensiles de cuisine ; sans les corroder et comme additif de rinçage pour éliminer les traces de détergent. On le trouve sous forme liquide concentré ou sous forme de sels facilement solubles dans l'eau à température ambiante.
Assez oxydant contre le tartre (composé essentiellement de dépôts de carbonates de calcium et souvent de traces de sulfure malodorant, le soufre étant utilisé pour le traitement des eaux de ville très dures) et assez stable au voisinage de la température d'ébullition de l'eau, il n'altère pas les parties métalliques des chaudières ni les joints d'étanchéité (tant qu'ils ne sont pas déjà altérés par le tartre qui va être dissous). Les traces résiduelles d’acide citrique ou malique, après un court rinçage de ces deux acides, n'altèrent pas non plus le goût et les arômes du café ou du thé préparé dans les premiers cycles après le détartrage (contrairement au détartrage au vinaigre blanc ou acide acétique, qui oxyde les cuves en aluminium ou en fonte) et n'ont pas de caractère toxique à l'ingestion à ces dosages faibles. Les vapeurs dégagées lors du cycle de détartrage sont également beaucoup moins irritantes que celles des produits à base de chlore ou d'acide acétique. Toutefois il ne faut pas mélanger cet acide avec des produits chlorés comme l'eau de Javel, à cause du dégagement important de chlore gazeux (source fréquente d'intoxication par les produits nettoyants ménagers par inhalation accidentelle).
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Malic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 juillet 2016 (JavaScript nécessaire).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8).
- « (+-)-Malic acid », sur reciprocalnet.org (consulté le ).
- Henri Cottez, « Les bases épistémologiques et linguistiques de la nomenclature chimique de 1787 », Meta, vol. 39, no 4, , p. 676-691 (DOI 10.7202/002408ar, lire en ligne).
- Guyton-Morveau, Antoine Lavoisier, Claude-Louis Berthollet et Antoine-François de Fourcroy, Méthode de nomenclature chimique (1787), p. 108.
- (en) Richard H. Wiley, Newton R. Smith, C. F. H. Allen et George A. Reynolds, « Coumalic Acid », Organic Syntheses, vol. 31, , p. 23 (DOI 10.15227/orgsyn.031.0023, lire en ligne).
- Centre technique interprofessionnel de la vigne et du vin - ITV Midi-Pyrénées, « Les acides organiques du raisin », (consulté le ).
Annexes
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) DL-Malic acid, Compendium of Food Additive Specifications (Addendum 7), Joint FAO/WHO Expert Committee on Food Additives 53rd session, Rome, 1-10 juin 1999