Kubični kristalni sistem



Kubični ali izomerni kristalni sistem kristalni sistem, v katerem ima osnovna celica obliko kocke. Kocka je ena od najbolj običajnih in najenostavnejših oblik kristalov in mineralov.
Kubični kristalni sistem ima tri osnovne različice: primitivno, telesno in ploskovno centrirano kocko in številne variante, ki so naštete kasneje. Osnovna celica sistema je po dogovoru kocka, čeprav primitivna kocka to pogosto ni. Odstopanje je posledica pojava, da je v večini kubičnih kristalnih sistemov v osnovni celici več kot en atom.
Bravaisove mreže in točkovne/prostorske skupine
[uredi | uredi kodo]Kubični kristalni sistem ima tri Bravaisove mreže:
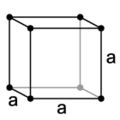
|

|

|
| primitivna kocka (P) | telesno centrirana kocka (I) | ploskovno centrirana kocka (F) |
Primitivna kocka ima mrežne točke samo v ogliščih kocke. Vsak atom v mrežni točki je zato enakomerno razdeljen med osmimi sosednjimi kockami. Osnovna celica vsebuje skupno en atom (⅛ × 8 = 1).
Telesno centrirana kocka ima poleg osmih mrežnih točk v ogliščih kocke še eno mrežno točko v središču kocke. To pomeni, da ima skupno dva atoma (⅛ × 8 + 1 = 2).
Ploskovno centrirana kocka ima poleg osmih mrežnih točk v ogliščih kocke še po eno mrežno točko na vsaki ploskvi, katero si deli s sosednjo kocko. Skupno ima torej štiri atome (⅛ × 8 + ½ × 6 = 4).
Če bi hoteli ustvariti C-centrirani kristalni sistem, se pravi da bi v središče vsake vodoravne ploskve postavili dodatno mrežno točko, bi dobili enostavno tetragonalno Bravaisovo mrežo.
Kristalni razredi
[uredi | uredi kodo]V naslednji preglednici so prikazana imena kristalnih razredov, primeri, Schönfliesova notacija, Hermann–Mauguinova notacija, točkovne skupine, številke kristalografskih prostorskih skupin v Mednarodnih tabelah za kristalografijo,[1] orbifold, tip in prostorske skupine kubičnega kristalnega sistema. V sistemu je skupno 36 kubičnih prostorskih skupin.
| Kristalni razred | Primer | Schönfliesova notacija | Hermann–Mauguinova notacija | Točkovna skupina | # | Orbifold | Tip | Kubične prostorske skupine | |||||||||
| Tetaroidalni[2] | Ulmanit | T | 23 | 23 | 195-199 | 332 | enantiomorfni | P23 | F23 | I23 | P213 | I213 | |||||
| Diploidalni[2] | Pirit | Th | 2/m3 | m3 | 200-206 | 3*2 | centralno simetrični | Pm3 | Pn3 | Fm3 | Fd3 | I3 | Pa3 | Ia3 | |||
| Giroidalni[2] | Petzit | O | 432 | 432 | 207-214 | 432 | enantiomorfni | P432 | P4232 | F432 | F4132 | I432 | P4332 | P4132 | I4132 | ||
| Hekstetraedrični[2] | Sfalerit | Td | 43m | 43m | 215-220 | *332 | P43m | F43m | I43m | P43n | F43c | I43d | |||||
| Heksoktaedrični[2] | Galenit | Oh | 4/m32/m | m3m | 221-230 | *432 | centralno simetrični | Pm3m | Pn3n | Pm3n | Pn3m | Fm3m | Fm3c | Fd3m | Fd3c | Im3m | Ia3d |
Gostota atomskega sklada
[uredi | uredi kodo]Pomembna značilnost kristalnih struktur je njihova gostota. Gostota struktur se izračunava s predpostavko, da so vsi atomi enake kroglice z dovolj velikim premerom, da se dotikajo sosednjih kroglic. Gostota sklada je delež prostora, ki je zapolnjen s temi kroglicami.
Če je v vsaki mrežni točki po en atom, je v enostavni kubični mreži z dolžino stranice a ena kroglica s polmerom a/2. Gostota takšnega sklada je približno 0,524, kar je dokaj malo. Telesno centrirana kocka ima gostoto 0,680, ploskovno centrirana kocka pa 0,740, kar je največja teoretično možna vrednost, čeprav imajo takšno gostoto tudi druge kristalne mreže, na primer heksagonalni gosti sklad in ena od tetraedričnih telesno centriranih kock.
Ker se atomi v gostih skladih med seboj praviloma privlačijo, so skladi običajno gostejši. Možni so tudi redkejši skladi, na primer če hibridizacija orbital zahteva določene vezne kote. Enostavna kubična struktura s posebno majhno gostoto je v naravi redka, prisotna pa je na primer v poloniju.[3] Telesno in ploskovno centrirani kocki sta v naravi precej pogosti. Telesno centrirano kocko imajo na primer železo, krom, volfram in niobij, ploskovno centrirano kocko pa svinec (svinčev(II) nitrat), aluminij, baker, zlato in srebro.
Večatomske spojine
[uredi | uredi kodo]Spojine, ki so sestavljene iz več kot enega elementa, na primer binarne spojine, imajo pogosto kristalne strukture, ki temeljio na kubičnem kristalnem sistemu.
Struktura cezijevega klorida
[uredi | uredi kodo]

Ena od struktur je prepletena enostavna kubična struktura, imenovana tudi struktura cezijevega klorida, v kateri cezijevi in klorovi ioni tvorijo ločeni enostavni kubični strukturi. Cezijevi ioni so v središču vsake kocke klorovih ionov in obratno. Razporeditev ionov v celoti je enaka telesno centrirani kocki, vendar z izmenjajočimi se vrstami ionov na različnih mrežnih točkah (slika).
Takšno kristalno strukturo ima poleg cezijevega klorida še nekaj drugih alkalijskih halogenidov, pripravljenih pri nizkih temperaturah ali visokih tlakih.[4] Struktura je na splošno bolj verjetna, kadar je sestavljena iz dveh elementov s približno enakimi ionskimi polmeri (ionski polmer Cs+ = 167 pm in Cl- = 181 pm).
Prostorska skupina ima v Hermann-Mauguinovi notaciji oznako Pm3m, v Mednarodnih preglednicah za kristalografijo pa "#221". Skupina ima v klasifikaciji urejenih poliatomskih kristalnih struktur Strukturbericht oznako "B2".[5]
Koordinacijsko število vsakega iona v strukturi je 8: centralni kation je koordiniran z 8 anioni na ogliščih kocke, centralni anion pa je na enak način koordiniran z 8 kationi v ogliščih druge kocke.
Struktura kamene soli
[uredi | uredi kodo]
Druga struktura je struktura kamene soli ali struktura halita (natrijevega klorida). V tej strukturi tvorijo istovrstni ioni ločeni ploskovno centrirani kocki, ki se prepletata v obliki šahovnice (slika).
Takšno strukturo imajo poleg halita tudi skoraj vsi alkalijski halogenidi, mnogi dvovalentni kovinski oksidi, sulfidi, selenidi in teluridi.[4] Struktura je na splošno bolj verjetna kadar je kation malo manjši od aniona oziroma kadar so razmerja med ionskimi polmeri kationov in anionov na območju 0,414 do 0,732.
Prostorska skupina ima Hermann-Mauguinovi notaciji oznako Fm3m, v Mednarodnih preglednicah za kristalografijo pa "#225". Skupina ima v klasifikaciji urejenih poliatomskih kristalnih struktur Strukturbericht oznako "B1"[6]
Koordinacijsko število vsakega iona v tej strukturi je enako 6: vsak kation je koordiniran s šestimi anioni v ogliščih oktaedra, vsak anion pa je na podoben način koordiniran s 6 kationi v ogliščih sosednjega oktaedra.
Struktura cinkove svetlice
[uredi | uredi kodo]
Tretja struktura je struktura cinkove svetlice oziroma sfalerita (α-ZnS). Podobno kot v kameni soli sta tudi v tej strukturi udeležena dva raznovrstna atoma, ki tvorita dve med seboj prepleteni ploskovno centrirani kocki. Struktura se razlikuje od strukture kamene soli po relativnem položaju obeh kristalnih rešetk. Celotna razporeditev atomov je enaka razporeditvi v diamantni kubični strukturi, vendar z izmeničnimi vrstami atomov na različnih mrežnih položajih (slika).
Takšno kristalno strukturo imajo poleg cinkove svetlice tudi mnoge spojine polprevodnikov, na primer galijev arzenid in kadmijev telurid, in mnoge druge binarne spojine.
Prostorska skupina strukture se v Hermann-Mauguinovi notaciji imenuje F43m, v Mednarodnih preglednicah za kristalografijo pa "#216".[7][8] Skupina ima v klasifikaciji urejenih poliatomskih kristalnih struktur Strukturbericht oznako "B3".[9]
Sklici
[uredi | uredi kodo]- ↑ Prince, E., ur. (2006). International Tables for Crystallography. International Union of Crystallography. doi:10.1107/97809553602060000001. ISBN 978-1-4020-4969-9.
- ↑ 2,0 2,1 2,2 2,3 2,4 Crystallography and Minerals Arranged by Crystal Form, Webmineral
- ↑ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0080379419. The original discovery was in J. Chem. Phys. 14, 569 (1946), web link. Also see this more recent non-technical article.
- ↑ 4,0 4,1 Seitz, Modern Theory of Solids (1940), p.49
- ↑ »The CsCl (B2) Structure«. Arhivirano iz prvotnega spletišča dne 15. septembra 2008. Pridobljeno 20. junija 2010.
- ↑ »The NaCl (B1) Structure«. Arhivirano iz prvotnega spletišča dne 19. oktobra 2008. Pridobljeno 20. junija 2010.
- ↑ L. Kantorovich (2004). Quantum Theory of the Solid State. Springer. str. 32. ISBN 1402021534.
- ↑ Birkbeck College, University of London
- ↑ »The Zincblende (B3) Structure«. Arhivirano iz prvotnega spletišča dne 19. oktobra 2008. Pridobljeno 20. junija 2010.
Vir
[uredi | uredi kodo]- Hurlbut, Cornelius S.; Klein, Cornelis (1985). Manual of Mineralogy (20 izd.). John Wiley & Sons, New York. COBISS 12123141. ISBN 0-471-80580-7.