Reakcja Boudouarda
Reakcja Boudouarda – reakcja redoks mieszaniny tlenku węgla i dwutlenku węgla, pozostającej w równowadze chemicznej w danej temperaturze, polegająca na dysproporcjonowaniu tlenku węgla do dwutlenku węgla oraz grafitu[1]:
- 2 CO ⇌ CO2 + C
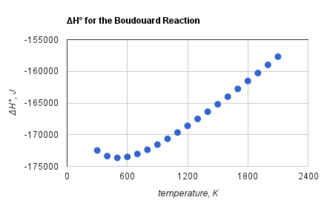
Tworzenie się dwutlenku węgla i węgla w reakcji Boudouarda jest procesem egzotermicznym w całym zakresie temperatur. Jednakże entalpia standardowa tej reakcji staje się mniej ujemna wraz ze wzrostem temperatury[potrzebny przypis].
Chociaż entalpia tworzenia CO2 jest większa niż entalpia tworzenia CO, jednak entropia tworzenia znacznie mniejsza. W rezultacie standardowa energia swobodna tworzenia CO2 z pierwiastków składowych prawie nie zmienia się i nie zależy od temperatury, natomiast energia swobodna tworzenia CO maleje wraz z temperaturą. W wysokich temperaturach reakcja przebiegająca w prawo jest zatem endoenergetyczna, faworyzując odwrotną reakcję w kierunku CO, mimo że reakcja przebiegająca w prawo jest nadal egzotermiczna[potrzebny przypis].
Przypisy
[edytuj | edytuj kod]- ↑ Bioenergylist.org – Boudouard Reaction spreadsheet. [dostęp 2012-02-22]. [zarchiwizowane z tego adresu (2012-02-22)].