Aluminium klorida

| |
| |
| Nama | |
|---|---|
| Nama IUPAC
aluminium klorida
| |
| Nama lain
aluminium(III) klorida
| |
| Pengecam | |
| |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.371 |
PubChem CID
|
|
| Nombor RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| AlCl3 | |
| Jisim molar | 133.34 g/mol (kontang) 241.43 g/mol (heksahidrat) |
| Rupa bentuk | pepejal putih atau kuning pucat, higroskopik |
| Ketumpatan | 2.48 g/cm3 (kontang) 1.3 g/cm3 (heksahidrat) |
| Takat lebur | 192.4 °C (378.3 °F; 465.5 K) |
| Takat didih | 120 °C (248 °F; 393 K) |
| 43.9 g/100 ml (0 °C) 44.9 g/100 ml (10 °C) 45.8 g/100 ml (20 °C) 46.6 g/100 ml (30 °C) 47.3 g/100 ml (40 °C) 48.1 g/100 ml (60 °C) 48.6 g/100 ml (80 °C) 49 g/100 ml (100 °C) | |
| Keterlarutan | larut di dalam hidrogen klorida, etanol, kloroform, karbon tetraklorida agak larut di dalam benzena |
| Tekanan wap | 133.3 Pa (99 °C) 13.3 kPa (151 °C)[1] |
| Kelikatan | 0.35 cP (197 °C) 0.26 cP (237 °C)[1] |
| Struktur | |
| Struktur kristal | Monoklinik, mS16 |
| Kumpulan ruang | C12/m1, No. 12 |
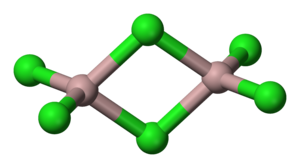
| Geometri koordinasi |
Oktahedral (pepejal) Tetrahedral (cecair) |
| Bentuk molekul | Satah trigonal (wap monomerik) |
| Termokimia | |
| Muatan haba tentu, C | 91 J/mol·K[1] |
| Entropi molar piawai S |
111 J/mol·K[2] |
Entalpi pembentukan
piawai (ΔfH⦵298) |
−704.2 kJ/mol[1][2] |
Tenaga bebas Gibbs (ΔfG˚)
|
-628.6 kJ/mol[1] |
| Bahaya | |
| Piktogram GHS |  [3] [3]
|
| Perkataan isyarat GHS | Danger |
| H314[3] | |
| P280, P310, P305+351+338[3] | |
| NFPA 704 (berlian api) | |
| Dos maut (LD) atau kepekatan dos maut (LC) | |
LD50 (median dos)
|
kontang: 380 mg/kg, tikus (mulut) heksahidrat: 3311 mg/kg, tikus (mulut) |
| Sebatian berkaitan | |
Anion lain
|
Aluminium fluorida Aluminium bromida Aluminium iodida |
Kation lain
|
Boron triklorida Galium triklorida Indium(III) klorida Magnesium klorida |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Aluminium klorida (AlCl3) ialah sebatian utama bagi aluminium dan klorin. Sebatian ini putih, tetapi sampel-sampelnya kerap tercemar dengan ferum triklorida, memberikannya warna kuning. Pepejal ini mempunyai takat lebur dan takat didih rendah. Bahan ini terutamanya dihasilkan dan digunakan dalam penghasilan logam aluminium, tetapi amaun besar juga digunakan dalam bidang industri kimia lain. Sebatian ini kerap dikutip sebagai sebagai asid Lewis. Pepejal ini merupakan satu contoh sebatian organik yang meretak pada suhu sederhana, secara berbalik berubah daripada polimer kepada monomer.
Penghasilan
[sunting | sunting sumber]Aluminium klorida boleh dihasilkan melalui tindak balas eksotermik logam aluminium dengan gas klorin ataupun hidrogen klorida pada suhu 650 hingga 750 °C.[4]
Selain itu, sebatian klorida boleh dihasilkan melalui tindak balas aluminium dan kuprum klorida.
Rujukan
[sunting | sunting sumber]- ^ a b c d e http://chemister.ru/Database/properties-en.php?dbid=1&id=353
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ a b c Sigma-Aldrich Co., Aluminum chloride. Dicapai pada 5 Mei 2014.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4. Cite has empty unknown parameter:
|1=(bantuan)
Pautan luar
[sunting | sunting sumber]| Wikimedia Commons mempunyai media berkaitan Aluminium klorida |
- International Chemical Safety Card 1125
- Index of Organic Synthesis procedures that utilize AlCl3
- The period 3 chlorides
- MSDS
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
{{#switch:||Kategori=
