スガマデクス
 | |
 | |
| 臨床データ | |
|---|---|
| 発音 | soo GAM ma dex |
| 販売名 | Bridion |
| Drugs.com | monograph |
| ライセンス | EMA:リンク、US Daily Med:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| データベースID | |
| CAS番号 |
343306-71-8 |
| ATCコード | V03AB35 (WHO) |
| PubChem | CID: 6918585 |
| DrugBank |
DB06206 |
| ChemSpider |
32689915 |
| UNII |
361LPM2T56 |
| ChEBI |
CHEBI:90953 |
| ChEMBL | CHEMBL2111107 |
| 別名 | ORG-25969 |
| 化学的データ | |
| 化学式 | C72H112O48S8 |
| 分子量 | 2,002.12 g·mol−1 |
| |
| |
スガマデクス(Sugammadex)は、全身麻酔でロクロニウム又はベクロニウム[5]によって誘発される神経筋遮断から回復させるための薬剤である。
ブリディオン(Bridion)というブランド名で販売されている。
概要
[編集]これは最初の選択的筋弛緩薬結合薬(SRBA) である。メルク社から販売されている[6]。
本剤とロクロニウムを組み合わせる事で、筋弛緩作用の調節性が劇的に高まった。気道確保の安全性向上に大きく貢献している薬剤である。麻酔科学上のインパクトは"ゲームチャンジャー"とすら称される[7][8][9]。スガマデクスとロクロニウムの組み合わせと、単剤で同等の調節性を持つ薬剤には、古くから用いられてきたスキサメトニウムが存在するが、致死的が高い悪性高熱のリスクを伴う。
最も一般的な副作用には、咳、麻酔効果消失による気道の問題、血圧の低下、および心拍数の変化などのその他の合併症が含まれる[3]。
用語について(拮抗と回復)
[編集]スガマデクスは、ロクロニウムまたはベクロニウムによって誘発される神経筋遮断の回復を適応と している[5] [3]。なお、作用機序は受容体拮抗薬ではなく化学的拮抗薬である[10]。日本語添付文書上、拮抗や拮抗薬という記載が無く、薬効分類名は筋弛緩回復剤である[11]。本稿ではこれに倣い、以下の記載において、麻酔科領域で頻用される拮抗は使用せず、回復で統一する。なお、スガマデクス販売以前に同じ用途で頻用されていたネオスチグミンとアトロピンの合剤、商品名 アトワゴリバースは添付文書上、その作用が筋弛緩作用の拮抗となっている[12]。アトワゴリバースはの筋弛緩拮抗の有効成分はネオスチグミンである。神経筋遮断薬が神経筋接合部のニコチン受容体を遮断するのに対し、ネオスチグミンは神経筋接合部ニコチン受容体アゴニストのアセチルコリンの分解を阻害することで間接的にアセチルコリンを増加させることにより、神経筋遮断薬の効果を減弱、すなわち広義の拮抗作用を生じる。この作用はネオスチグミンの受容体への直接作用によらないので、生理学的拮抗ということになる。
薬理学
[編集]薬力学
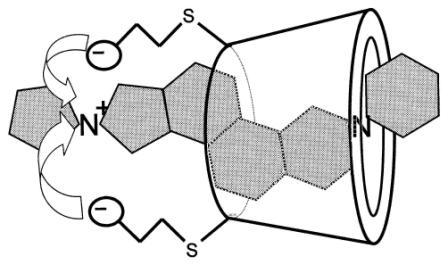
[編集]スガマデクスは修飾γ-シクロデキストリンであり、親油性コアと親水性周辺を有する。このγ- シクロデキストリンは、6 番目の炭素位置に 8 つのカルボキシルチオエーテルグループを配置することによって、その本来の状態から変更されている。これらの拡張により、分子内腔が拡張され、ロクロニウム分子のより大きなカプセル化が可能になる。これらの負に帯電した側鎖は、ターゲットの第4級窒素に静電気的に結合するだけでなく、シクロデキストリンの水性の性質にも寄与する。ロクロニウムのスガマデクスの結合カプセル化は、シクロデキストリンとそのゲスト分子の中で最も強力なものの 1 つである。スガマデクスの親油性コア内に結合したロクロニウム分子 (修飾ステロイド) は、神経筋接合部のアセチルコリン受容体に結合できなくなる。
スガマデクスは、ネオスチグミンとは異なり、アセチルコリンエステラーゼを阻害しないため、コリン作動性作用(徐脈や唾液分泌増加など)は生じず、抗ムスカリン剤(臭化グリコピロニウムまたはアトロピン)の同時投与は必要ない。したがって、スガマデクスは、従来のコリンエステラーゼ阻害薬よりも副作用が少ないと期待され得る。
即効性があり作用持続時間が短い筋弛緩薬が必要な場合、サクシニルコリン以外の選択肢はほとんどなかったが、この薬には重大な禁忌がある。たとえば、影響を受けやすい個人では悪性高熱を引き起こす可能性があり、偽コリンエステラーゼ欠乏症の患者では作用時間が長くなり、状況によっては危険な血漿カリウム濃度の上昇を引き起こす。ロクロニウムは、高用量 (0.6 mg kg −1から 1 mg kg -1 ) で比較的迅速な効果発現が得られ、スガマデクスで迅速に回復させることができる (16 mg kg -1 )、したがって、この薬物の組み合わせは、スキサメトニウムに代わるものとなる。
神経筋遮断の再発の現象である「再クラーレ化」は、神経筋遮断薬が完全に消失する前にコリンエステラーゼ阻害薬の効果が切れた場合に発生する可能性がある。これは、最も長く作用する神経筋遮断薬 (ガラミン、パンクロニウム、ツボクラリンなど) を除いて、非常に稀である。スガマデクスではまれにしか発生せず、投与量が不十分な場合にのみ発生することが示されている[13]。根底にあるメカニズムは、筋弛緩回復後の筋弛緩薬の再分布に関連していると考えられている。中央コンパートメントでの筋弛緩薬との複合体形成には十分であるが、末梢コンパートメントから中央に戻る追加の筋弛緩薬には不十分な、相対的に少ないスガマデクスの用量で発生する可能性がある[14]。
スガマデクスは、他の 2 つのアミノステロイド神経筋遮断薬であるベクロニウムとパンクロニウムに親和性があることが示されている。スガマデクスのベクロニウムに対する親和性はロクロニウムよりも低いが、ベクロニウムによる筋弛緩からの回復にはそれでも効果的である.これは、同等の遮断のために生体内に存在するベクロニウム分子が少ないためである.ベクロニウムはロクロニウムよりも約7倍強力である。スガマデクスは 1:1 の比率でカプセル化されているため、ロクロニウムと比較して結合する分子が少ないため、ベクロニウムからの筋弛緩から適切に回復する[15]。浅いパンクロニウムによる神経筋遮断は、第 III 相臨床試験でスガマデクスによる回復が確認された[16]。
効能
[編集]迅速導入におけるその適合性を調べる研究がヨーロッパで実施された。スガマデクスは、高用量のロクロニウムによって誘発される神経筋遮断を用量依存的に迅速に回復することがわかった[17]。
スガマデクスに関する2009年のコクランレビューによれば、「スガマデクスは、手術中の神経筋遮断によって引き起こされる筋弛緩を回復させることにおいて、プラセボ(投薬なし)またはネオスチグミンよりも効果的であることが示されており、比較的安全である。重篤な合併症は、スガマデクスを投与された患者の 1% 未満で発生した。この総説記事の結果 (特に安全性の結果) は、より多くの患者集団を対象とした今後の試験で確認する必要がある」[18]。 2017年のコクラン レビューでは、スガマデクスはネオスチグミンよりも安全性が高く、有害事象が 40% 少ないと結論付けている[19]。具体的には、スガマデクスを回復薬として使用すると、術後の残存麻痺、徐脈、吐き気、嘔吐のリスクが軽減される。 British Journal of Anesthesia誌は 2015 年に、スガマデクスを筋弛緩回復剤として使用し、神経筋モニタリングを使用して正しい投与量を選択した場合、残留神経筋遮断の発生率をゼロに減らすことができるという記事を掲載した[20]。また、各薬剤の回復時間を比較すると、スガマデクスがネオスチグミンよりも 10.22分 (6.6 倍) 速かったことを示している (1.96 対 12.87 分)。スガマデクスは、ネオスチグミン (2.9 対 48.8 分) よりも 45.78 分 (16.8 倍) 速く、深い筋弛緩を回復した[19]。迅速な筋弛緩からの回復と術後の残存麻痺の減少によって節約される時間は、病院全体のコストを削減し、患者の安全性を大幅に改善する可能性がある[21]。しかし、2022年の報告では、米国においては、高リスク患者においては、むしろ医療費増加と関連していることが観察されている[22]。
忍容性
[編集]スガマデクスは一般に、外科患者または健康なボランティアを対象とした臨床試験で忍容性が良好であった。プール解析では、スガマデクスの忍容性プロファイルは、プラセボまたはネオスチグミンとグリコピロレートの忍容性プロファイルとほぼ同様であった[23]。スガマデクスは、プロゲストゲンに結合する可能性があることを示した in vitro結合研究からの証拠により、理論的にはホルモン避妊薬を阻害する可能性がある[5]。
歴史
[編集]スガマデクスは、スコットランドのNewhouse Research Siteで製薬会社オルガノンによって発見された[24]。オルガノンは 2007 年にシェリング・プラウに買収された。シェリング・プラウは 2009 年にメルクと合併した。 スガマデクスは現在、メルクが所有および販売している。
米国食品医薬品局(FDA) は、当初、2008 年にシェリング プラウのスガマデクスの新薬申請を却下した[25]が、最終的に2015 年 12 月に米国での使用を承認した[26] [27]。スガマデクスは、2008 年 7 月にEUでの使用が承認された[3] [28]。
脚注
[編集]- ^ https://www.tga.gov.au/resources/prescription-medicines-registrations/sugammadex-accord-accord-healthcare-pty-ltd
- ^ https://www.tga.gov.au/resources/prescription-medicines-registrations/sugammadex-sandoz-sandoz-pty-ltd
- ^ a b c d “Bridion EPAR”. European Medicines Agency (EMA). 10 June 2020時点のオリジナルよりアーカイブ。10 June 2020閲覧。
- ^ “Bridion 100 mg/ml solution for injection - Summary of Product Characteristics (SmPC)”. (emc) (18 March 2021). 27 June 2021時点のオリジナルよりアーカイブ。27 June 2021閲覧。
- ^ a b c d “Bridion- sugammadex injection, solution”. DailyMed (14 December 2018). 10 June 2020時点のオリジナルよりアーカイブ。10 June 2020閲覧。
- ^ “Dosing for Bridion (sugammadex)”. www.merckconnect.com. 2019年1月12日時点のオリジナルよりアーカイブ。2019年1月11日閲覧。
- ^ Michael W, Lew; Joseph, Chang (2020-06-04). “Sugammadex-Is Cost the Only Drawback?”. International Journal of Anesthetics and Anesthesiology 7 (2). doi:10.23937/2377-4630/1410108.
- ^ “Reversal of Neuromuscular Blockade by Sugammadex for Stimulator-Guided Nerve Blocks After Tracheal Intubation: Is It Necessary? | AJA Asian Journal of Anesthesiology” (英語). www.aja.org.tw. 2023年1月5日閲覧。
- ^ Hung, Orlando; McKeen, Dolores; Huitink, Johannes (2016-08-01). “Our love-hate relationship with succinylcholine: Is sugammadex any better?” (英語). Canadian Journal of Anesthesia/Journal canadien d'anesthésie 63 (8): 905–910. doi:10.1007/s12630-016-0664-4. ISSN 1496-8975.
- ^ Kurçaloğlu, Mustafa; Sarıhasan, Bahriye Binnur; Çetinoğlu, Erhan Çetin (2020). “Comparing the effects of sugammadex and neostigmine on neuromuscular block and bispectral index in recovery from intracranial mass resection operations”. Eastern Journal Of Medicine 25 (3): 371–377. doi:10.5505/ejm.2020.99705. ISSN 1301-0883.
- ^ “ブリディオン静注200mg/ブリディオン静注500mg”. www.info.pmda.go.jp. 2022年12月30日閲覧。
- ^ “アトワゴリバース静注シリンジ3mL/アトワゴリバース静注シリンジ6mL”. www.info.pmda.go.jp. 2022年12月30日閲覧。
- ^ Miller R (2007). “Sugammadex: an opportunity to change the practice of anesthesiology?”. Anesth Analg 104 (3): 477–8. doi:10.1213/01.ane.0000255645.64583.e8. PMID 17312188.
- ^ Eleveld DJ; Kuizenga, K; Proost, JH; Wierda, JM (2008). “A Temporary Decrease in Twitch Response During Reversal of Rocuronium-Induced Muscle Relaxation with a Small Dose of Sugammadex”. Anesth Analg 104 (3): 582–4. doi:10.1213/01.ane.0000250617.79166.7f. PMID 17312212.
- ^ Welliver M (2006). “New drug sugammadex; A selective relaxant binding agent”. AANA J 74 (5): 357–363. PMID 17048555.
- ^ Decoopman M (2007).
- ^ “Reversal of profound, high-dose rocuronium-induced neuromuscular blockade by sugammadex at two different time points: an international, multicenter, randomized, dose-finding, safety assessor-blinded, phase II trial”. Anesthesiology 109 (2): 188–97. (August 2008). doi:10.1097/ALN.0b013e31817f5bc7. PMID 18648227.
- ^ “Sugammadex, a selective reversal medication for preventing postoperative residual neuromuscular blockade”. Cochrane Database of Systematic Reviews (4): CD007362. (October 2009). doi:10.1002/14651858.CD007362.pub2. PMID 19821409.
- ^ a b Hristovska, Ana-Marija; Duch, Patricia; Allingstrup, Mikkel; Afshari, Arash (2017-08-14). “Efficacy and safety of sugammadex versus neostigmine in reversing neuromuscular blockade in adults”. Cochrane Database of Systematic Reviews 8 (9): CD012763. doi:10.1002/14651858.cd012763. ISSN 1465-1858. PMC 6483345. PMID 28806470.
- ^ Brueckmann, B.; Sasaki, N.; Grobara, P.; Li, M. K.; Woo, T.; de Bie, J.; Maktabi, M.; Lee, J. et al. (November 2015). “Effects of sugammadex on incidence of postoperative residual neuromuscular blockade: a randomized, controlled study”. British Journal of Anaesthesia 115 (5): 743–751. doi:10.1093/bja/aev104. ISSN 1471-6771. PMID 25935840.
- ^ Azimaraghi, Omid; Ahrens, Elena; Wongtangman, Karuna; Witt, Annika S.; Rupp, Samuel; Suleiman, Aiman; Tartler, Tim M.; Wachtendorf, Luca J. et al. (2022-12-17). “Association of sugammadex reversal of neuromuscular block and postoperative length of stay in the ambulatory care facility: a multicentre hospital registry study” (英語). British Journal of Anaesthesia. doi:10.1016/j.bja.2022.10.044. ISSN 0007-0912.
- ^ Wachtendorf, Luca J.; Tartler, Tim M.; Ahrens, Elena; Witt, Annika S.; Azimaraghi, Omid; Fassbender, Philipp; Suleiman, Aiman; Linhardt, Felix C. et al. (2022-12-21). “Comparison of the effects of sugammadex versus neostigmine for reversal of neuromuscular block on hospital costs of care” (English). British Journal of Anaesthesia 0 (0). doi:10.1016/j.bja.2022.10.015. ISSN 0007-0912. PMID 36564246.
- ^ Yang LPH, Keam SJ (2009). “PDF”. Drugs 69 (7): 919–942. doi:10.2165/00003495-200969070-00008. PMID 19441874 2010年3月29日閲覧。.
- ^ Naguib M (2007). “Sugammadex: another milestone in clinical neuromuscular pharmacology.”. Anesth Analg 104 (3): 575–81. doi:10.1213/01.ane.0000244594.63318.fc. PMID 17312211.
- ^ "U.S. FDA Issues Action Letter for Sugammadex" (Press release). Schering-Plough. 1 August 2008. 2008年8月10日時点のオリジナルよりアーカイブ。2008年8月2日閲覧。
- ^ “Bridion (sugammadex) Injection”. U.S. Food and Drug Administration (FDA) (4 February 2016). 10 June 2020時点のオリジナルよりアーカイブ。10 June 2020閲覧。
- ^ "FDA approves Bridion to reverse effects of neuromuscular blocking drugs used during surgery" (Press release). Food and Drug Administration. 15 December 2015. 2015年12月15日時点のオリジナルよりアーカイブ。2015年12月15日閲覧。
- ^ "Bridion (sugammadex) Injection - First and Only Selective Relaxant Binding Agent - Approved in European Union" (Press release). Schering-Plough. 29 July 2008. 2008年9月24日時点のオリジナルよりアーカイブ。2008年8月2日閲覧。