Halokarbon

Senyawa halokarbon adalah senyawa kimia di mana satu atau lebih atom karbon terikat secara kovalen dengan satu atau lebih atom halogen (fluor, klor, brom atau iodium – golongan 17) menghasilkan dalam pembentukan senyawa organofluorin, senyawa organoklorin, senyawa organobromin, dan senyawa organoiodin. Halokarbon klor adalah yang paling stabil dan disebut sebagai organoklorin.[1]
Banyak senyawa organik sintetis seperti plastik polimer, dan beberapa senyawa alami, mengandung atom halogen; Mereka dikenal sebagai senyawa terhalogenasi atau organohalogen. Organoklorin adalah organohalida industri yang paling umum digunakan, walaupun organohalida lainnya sering digunakan dalam sintesis organik. Kecuali untuk kasus yang sangat jarang terjadi, organohalida tidak diproduksi secara biologis, namun banyak obat merupakan organohalida. Khususnya, banyak obat-obatan seperti Prozac memiliki gugus trifluorometil.
Untuk informasi tentang kimia halida anorganik, lihat halida.
Keluarga kimia
[sunting | sunting sumber]
Halokarbon biasanya diklasifikasikan dalam cara yang sama seperti struktur senyawa organik yang memiliki atom hidrogen yang menempati situs molekul atom halogen dalam halokarbon. Di antara keluarga kimia tersebut adalah:[2]
- haloalkana—senyawa dengan atom karbon terikat secara tunggal
- haloalkena—senyawa dengan satu atau lebih ikatan rangkap dua antara atom-atom karbon
- haloaromatik—senyawa dengan karbon terikat dengan satu atau lebih cincin aromatik sederhana dengan awan pi berbentuk donut yang terdelokalisasi.
Atom halogen dalam molekul halokarbon sering disebut "substituen", seolah atom-atom tersebut telah disubstitusi untuk atom hidrogen. Namun halokarbon disiapkan dengan berbagai cara yang tidak melibatkan penggantian langsung halogen untuk hidrogen.
Sejarah dan konteks
[sunting | sunting sumber]
Beberapa halokarbon diproduksi dalam jumlah besar oleh mikroorganisme. Sebagai contoh, beberapa juta ton metil bromida diperkirakan diproduksi oleh organisme laut setiap tahunnya. Sebagian besar halokarbon yang ditemukan dalam kehidupan sehari-hari – pelarut, obat-obatan, plastik – buatan manusia.[3][4] Sintesis pertama dari halokarbon dicapai pada awal 1800-an. Produksi mulai berakselerasi saat sifat bermanfaatnya sebagai pelarut dan anestesi ditemukan. Pengembangan plastik dan elastomer sintetis telah menghasilkan skala produksi yang sangat luas. Sebagian besar obat adalah halokarbon.
Halokarbon alami
[sunting | sunting sumber]Sejumlah besar halokarbon yang terjadi secara alami diciptakan oleh api kayu, dioksin misalnya, atau aktivitas vulkanik. Sumber besar kedua adalah ganggang laut yang menghasilkan beberapa senyawa metana dan etana terklorinasi yang mengandung senyawa. Ada beberapa ribu halokarbon kompleks yang diketahui, diproduksi terutama oleh spesies laut. Meskipun senyawa klorin adalah mayoritas senyawa yang ditemukan, bromida, iodida dan fluorida juga telah ditemukan. Ungu Tyre, yang merupakan dibromoindigo, mewakili bromida, sedangkan tiroksin yang dikeluarkan dari kelenjar tiroid, adalah asam iodida, dan asam fluoroasetat yang sangat beracun adalah salah satu organofluorida yang langka. Ketiga perwakilan ini, tiroksin dari manusia, ungu Tyre dari bekicot dan fluoroasetat dari tumbuh-tumbuhan, juga menunjukkan bahwa spesies yang tidak terkait menggunakan halokarbon untuk beberapa keperluan.[5][6][7]
Penggunaan
[sunting | sunting sumber]
Halokarbon pertama yang digunakan secara komersial adalah ungu Tyre organobromida alami dari siput laut Murex brandaris.
Penggunaan umum untuk halokarbon adalah sebagai pelarut, pestisida, zat pendingin, minyak tahan api, bahan elastomer, semprotan dan pengemas, Pelapis isolator listrik, dan plastik. Banyak halokarbon memiliki kegunaan khusus di industri. Salah satu halokarbon, sukralosa, adalah pemanis.

Sebelum mereka diatur secara ketat, masyarakat umum sering menemui haloalkana sebagai pelarut cat dan pembersih seperti trikloroetana (1,1,1-trikloroetana) dan karbon tetraklorida, pestisida seperti 1,2-dibromoetana (EDB, etilen dibromida), dan zat pendingin seperti Freon-22 (merek dagang duPont untuk klorodifluorometana). Beberapa haloalkana masih banyak digunakan untuk pembersih industri, seperti metilen klorida (diklorometana), dan sebagai zat pendingin, seperti R-134a (1,1,1,2-tetrafluoroetana).
Haloalkena juga telah digunakan sebagai pelarut, termasuk perkloroetilena (Perc, tetrakloroetena), tersebar luas dalam dry cleaning, dan trikloroetilena (TCE, 1,1,2-trikloroetena). Haloalkena lainnya adalah blok pembangun kimia dari plastik seperti polivinil klorida ("vinil" atau PVC, kloroetena terklorinasi) dan Teflon (merek dagang duPont untuk tetrafluoroetena terpolimerisasi, PTFE).
Haloaromatik termasuk merek dagang Aroclor sebelumnya dari Monsanto Company untuk bifenil terpoliklorinasi, PCB), yang pernah banyak digunakan pada transformator daya dan kapasitor dan dalam pembuatan lilin (Union Carbide untuk naftalena terpoliklorinasi, PCN), pernah digunakan untuk insulasi listrik, dan klorobenzena dan turunannya, digunakan untuk desinfektan, pestisida seperti dikloro-difenil-trikloroetana (DDT, 1,1,1-trikloro-2,2-bis (p-klorofenil) etana), herbisida seperti 2,4-D (asam 2,4-diklorophenoksiasetat), askarel dielektrik (dicampur dengan PCB, tidak lagi digunakan di kebanyakan negara), dan bahan kimia.
Beberapa halokarbon, termasuk halida asam seperti asetil klorida, sangat reaktif; Senyawa ini jarang ditemukan di luar pengolahan kimia. Meluasnya penggunaan halokarbon sering didorong oleh pengamatan bahwa kebanyakan dari mereka lebih stabil daripada zat lainnya. Mereka mungkin kurang terpengaruh oleh asam atau basa; mereka mungkin tidak terbakar dengan mudah; mereka mungkin tidak diserang oleh bakteri atau kapang; atau mereka mungkin tidak terpengaruh oleh paparan sinar matahari.
Bahaya
[sunting | sunting sumber]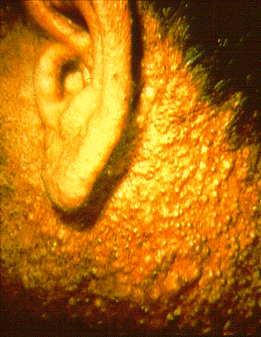
Stabilitas halokarbon cenderung mendorong kepercayaan bahwa mereka kebanyakan tidak berbahaya, walaupun pada pertengahan 1920-an dokter melaporkan pekerja di pabrik naftalena terpoliklorinasi menderita penyakit chloracne (Teleky 1927), dan pada akhir 1930-an diketahui bahwa pekerja yang terpapar PCN bisa meninggal karena penyakit hati. (Flinn & Jarvik 1936) dan DDT akan membunuh nyamuk dan serangga lainnya (Müller 1948). Pada tahun 1950-an, telah terjadi beberapa laporan dan penyelidikan tentang bahaya di tempat kerja. Pada tahun 1956, misalnya, setelah menguji minyak hidrolik yang mengandung PCB, Angkatan Laut Amerika Serikat menemukan bahwa kontak kulit dapat menyebabkan penyakit hati fatal pada hewan dan menolaknya sebagai "terlalu beracun untuk digunakan di kapal selam" (Owens v. Monsanto 2001).

Pada tahun 1962 sebuah buku oleh ahli biologi Amerika Serikat Rachel Carson (Carson 1962) memulai badai kekhawatiran tentang polusi lingkungan, pertama kali berfokus pada DDT dan pestisida lainnya, beberapa di antaranya juga merupakan halokarbon. Kekhawatiran ini diperkuat ketika pada tahun 1966 ahli kimia Swedia Soren Jensen melaporkan residu luas PCB di antara ikan dan burung Arktik dan sub-Arktik (Jensen 1966). Pada tahun 1974, ahli kimia Meksiko Mario Molina dan ahli kimia Amerika Serikat Sherwood Rowland memperkirakan bahwa pendingin halokarbon yang sama, klorofluorokarbon (CFC), akan terakumulasi di atmosfer bagian atas dan menghancurkan pelindung ozon (Molina & Rowland 1974). Dalam beberapa tahun, penipisan ozon diamati di atas Antartika, yang menyebabkan larangan produksi dan penggunaan klorofluorokarbon di banyak negara. Pada tahun 2007, Intergovernmental Panel on Climate Change mengatakan bahwa halokarbon merupakan penyebab langsung pemanasan global.[8]
Sejak tahun 1970-an, telah terjadi kontroversi yang belum terselesaikan mengenai bahaya kesehatan potensial trikloroetilena (TCE) dan pelarut halokarbon lainnya yang telah banyak digunakan untuk pembersih industri. (Anderson v. Grace 1986) (Scott & Cogliano 2000) (U.S. National Academies of Science 2004) (United States 2004). Baru-baru ini, asam perfluorooktanoat (PFOA), prekursor dalam proses pembuatan paling umum untuk Teflon dan juga digunakan untuk membuat lapisan untuk kain dan kemasan makanan, menjadi perhatian kesehatan dan lingkungan mulai tahun 2006. (United States 2010 (dimulai tahun 2006)), Menunjukkan bahwa halokarbon, meskipun dianggap sebagai yang paling inert, mungkin juga menimbulkan bahaya.
Halokarbon, termasuk yang mungkin tidak berbahaya bagi dirinya sendiri, dapat menyajikan isu pembuangan limbah. Karena mereka tidak mudah terdegradasi di lingkungan alami, halokarbon cenderung menumpuk. Insinerasi dan kebakaran yang tidak disengaja dapat menciptakan produk sampingan korosif seperti asam klorida dan asam fluorida, dan racun seperti halogenasi dioksin dan furan. Spesies Desulfitobacterium sedang diselidiki untuk potensinya dalam bioremediasi senyawa halogen organik.[9]
Lihat pula
[sunting | sunting sumber]Catatan
[sunting | sunting sumber]- ^ Yoel Sasson. "Formation of Carbon–Halogen Bonds (Cl, Br, I)" in Patai's Chemistry of Functional Groups (2009). Wiley-VCH, Weinheim. doi:10.1002/9780470682531.pat0011
- ^ M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_233.pub2
- ^ Fujimori, Danica Galonić; Walsh, Christopher T. (2007). "What's new in enzymatic halogenations". Current Opinion in Chemical Biology. 11 (5): 553–60. doi:10.1016/j.cbpa.2007.08.002. PMC 2151916
. PMID 17881282.
- ^ Gribble, Gordon W. (2004). "Natural Organohalogens: A New Frontier for Medicinal Agents?". Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ^ Gordon W. Gribble (1998), "Naturally Occurring Organohalogen Compounds", Acc. Chem. Res., 31 (3): 141–152, doi:10.1021/ar9701777.
- ^ Gordon W. Gribble (1999), "The diversity of naturally occurring organobromine compounds", Chemical Society Reviews, 28 (5): 335–346, doi:10.1039/a900201d.
- ^ Gordon W. Gribble (2002), Neilson, A. H., ed., "Naturally Occurring Organofluorines", Organofluorines, 3n: 121–136, doi:10.1007/10721878.
- ^ Climate Change 2007: The Physical Science Basis. Summary for Policymakers Diarsipkan 2007-02-03 di Wayback Machine., page 3
- ^ Villemur, R.; Lanthier, M.; Beaudet, R. ©J.; Lépine, F. §O. (2006). "TheDesulfitobacteriumgenus". FEMS Microbiology Reviews. 30 (5): 706–733. doi:10.1111/j.1574-6976.2006.00029.x. PMID 16911041.
Referensi
[sunting | sunting sumber]- Anderson v. Grace (1986), 628 F. Supp. 1219, Massachusetts, USA, settled between the parties, reviewed in Harr, J., Ed.; Asher, M., Ed. (1996), A Civil Action, Minneapolis, MN, USA: Sagebrush Education Resources
- Carson, R. (1962), Silent Spring, Boston, MA, USA: Houghton Mifflin
- Flinn, F.B.; Jarvik, N.E. (1936), "Action of certain chlorinated naphthalenes on the liver", Proceedings of the Society for Experimental Biology and Medicine, 35: 118–120, doi:10.3181/00379727-35-8879p
- Jensen, S. (1966), "Report of a new chemical hazard", New Scientist, 32: 612
- Molina, M.J.; Rowland, F.S. (1974), "Stratospheric sink for chlorofluoromethanes: chlorine atom-catalysed destruction of ozone", Nature, 249: 810–812, Bibcode:1974Natur.249..810M, doi:10.1038/249810a0
- Müller, P.H. (1948), "Dichloro-diphenyl-trichloroethane and newer insecticides" (PDF), Nobel Lecture, diarsipkan (PDF) dari versi asli tanggal 2008-07-09, diakses tanggal 2017-06-08
- Owens v. Monsanto (2001), 96-CV-440, Exhibit 3A03F (PDF), Alabama, USA, diarsipkan dari versi asli (PDF) tanggal 2006-09-28, diakses tanggal 2017-06-08, cited in Chemical Industry Archives, Anniston Case Diarsipkan 2005-07-18 di Wayback Machine., by Environmental Working Group, Washington, DC, 2002
- Scott, C.S., Ed.; Cogliano, V.J., Ed. (2000), "Trichloroethylene Health Risks--State of the Science", Environmental Health Perspectives, 108 (S2): 159–60, doi:10.1289/ehp.00108s2159, PMC 1637768
, PMID 10928830, diarsipkan dari versi asli tanggal 2006-02-19, diakses tanggal 2017-06-08
- Teleky, L. (1927), "Die pernakrankheit", Klinische Wochenschrift, Berlin: Springer, Jahrgänge 6: 845
- U.S. National Academies of Science, Current Projects System (2004), Assessing the Human Health Risks of Trichloroethylene, diarsipkan dari versi asli tanggal 2022-03-04, diakses tanggal 2017-06-08
- United States, Environmental Protection Agency (2004), Integrated Risk Information System, Trichloroethylene (CASRN 79-01-6), diarsipkan dari versi asli tanggal 2015-09-07, diakses tanggal 2017-06-08
- United States, Environmental Protection Agency (2010), PFOA Stewardship Program (begun in 2006), diarsipkan dari versi asli tanggal 2015-09-23, diakses tanggal 2017-06-08