Hidracina
| Hidracina | |
|---|---|
|

|

|

|
 Hidrato de hidracina
| |
Hidrazina[1] | |
| Identificadores | |
| Número CAS | 302-01-2 |
| PubChem | 9321 |
| ChemSpider | 8960 |
| UNII | 27RFH0GB4R |
| Número CE | 206-114-9 |
| Número UN | 2029 |
| KEGG | C05361 |
| MeSH | Hydrazine |
| ChEBI | CHEBI:15571 |
| ChEMBL | CHEMBL1237174 |
| Número RTECS | MU7175000 |
| Referencia Beilstein | 878137 |
| Referencia Gmelin | 190 |
| 3DMet | B00770 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
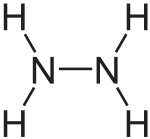
| Fórmula molecular | N2H4 |
| Masa molecular | 32,0452 g mol−1 |
| Aspecto | Líquido incoloro |
| Densidade | 1,021 g cm−3 |
| Punto de fusión | 2 °C; 35 °F; 275 K |
| Punto de ebulición | 114 °C; 237 °F; 387 K |
| log P | 0,67 |
| Presión de vapor | 1 kP (a 30,7 °C) |
| Acidez (pKa) | 8,10[3] |
| Basicidade (pKb) | 5,90 |
| Índice de refracción (nD) | 1,46044 (a 22 °C) |
| Viscosidade | 0,876 cP |
| Estrutura | |
| Forma da molécula | Piramidal triangular no N |
| Momento dipolar | 1,85 D[4] |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
50,63 kJ mol−1 |
| Entropía molar estándar S |
121,52 J K−1 mol−1 |
| Perigosidade | |
| MSDS | ICSC 0281 |
| Pictogramas GHS | 
|
| Palabra sinal GHS | DANGER |
| EU Index | 007-008-00-3 |
| Clasificación da UE | |
| Frases R | R45, R10, R23/24/25, R34, R43, R50/53 |
| Frases S | S53, S45, S60, S61 |
| NFPA 704 | |
| Punto de inflamabilidade | 52 °C; 126 °F; 325 K |
| Temperatura de autoignición | 24 to 270 °C (75 to 518 °F; 297 to 543 K) |
| Límites de explosividade | 1,8–99,99% |
| LD50 | 59–60 mg/kg (oral en ratas, ratos)[6] |
| Compostos relacionados | |
| Outros anións | tetrafluorohidrazina peróxido de hidróxeno difosfano difosforo tetraioduro |
| Outros catións | hidrazinas orgánicas |
| azanos binarios relacionados | Amoníaco triazano |
| Compostos relacionados | diazeno triazeno tetrazeno difosfeno |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
A hidracina é un composto químico líquido incoloro a temperatura e presión ambiente, irritante, corrosivo, inflamable e con olor a amoníaco.
Na súa forma sólida é de cor branca. A súa fórmula é N2H4 e obtense por reacción entre amoníaco, cloro e hidróxido sódico. É lixeiramente soluble en amoníaco e metilamina. É soluble en auga, metanol, etanol e etilenodiamida. Obtense mediante o proceso Raschig.
Un dos seus usos principais é como propelente para foguetes, sobre todo como monopropelente (usado en solitario) en satélites para manter a súa órbita e en manobras de control de altitude, como no caso de SEOSAT-Ingenio.[7] O seu uso en grandes foguetes caeu en desuso a favor da dimetilhidracina asimétrica (UDMH).[8][9]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 "hydrazine - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ "NIOSH Guide - Hydrazine". Centers for Disease Control. Consultado o 16 August 2012.
- ↑ Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
- ↑ "Hydrazine safety data sheet". Arquivado dende o orixinal o 01 de xaneiro de 2014. Consultado o 24 de febreiro de 2015.
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. p. 361. ISBN 1-903996-65-1.
- ↑ "SEOSAT-Ingenio: fully loaded". www.esa.int (en inglés). Consultado o 2020-10-22.
- ↑ "Hidracina". Real Academia Galega. Consultado o 2022-12-08.
- ↑ Mark Wade (2011). "Hydrazine" (en inglés). Consultado o 17 de abril de 2013.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Hidracina |




