Arĝenta klorido
Aspekto
| Arĝenta klorido | ||
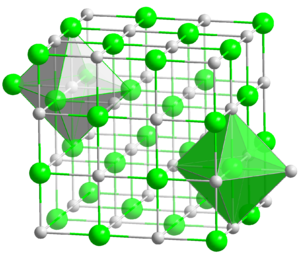 | ||
| Kristala strukturo de la Arĝenta klorido similas al tiu de la natria klorido | ||
 | ||
| Tridimensia strukturo de la Arĝenta klorido | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numero-kodo | 7783-90-6 | |
| ChemSpider kodo | 22967 | |
| PubChem-kodo | 24561 | |
| Merck Index | 14,8509 | |
| Fizikaj proprecoj | ||
| Aspekto | blanka solido | |
| Molmaso | 143.32 g·mol-1 | |
| Denseco | 5.56 g cm−3 | |
| Fandpunkto | 455 °C | |
| Bolpunkto | 1547 °C | |
| Refrakta indico | 2,071 | |
| Acideco (pKa) | x.xx | |
| Solvebleco | Akvo: | |
| Mortiga dozo (LD50) | 10 g/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Risko | R50 R53 | |
| Sekureco | S24/25 S60 S61 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj[2][3] | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H290, H335, H400, H410 | |
| GHS Deklaroj pri antaŭgardoj | P234, P261, P271, P273, P304+340, P312, P391, P403+233, P404, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Arĝenta klorido estas kemia neorganika komponaĵo, rezultanta el interagado de la arĝento kaj kloro. Ĝi estas blanka kristala salo kun malalta solvebleco en akvo, karakterizaĵo de la arĝentaj derivaĵoj. Ĝi estas stabila substanco en mallumo, ĉar en ĉeesto de lumo aŭ varmigado, arĝenta klorido malkomponiĝas en arĝenton kaj kloron, kiu perceptiĝas laŭ kolorŝanĝo el blanka al griza en kelkaj specimenoj. Arĝenta klorido estas nature trovata en la mineralo konata kiel klorargirito.
Sintezo
[redakti | redakti fonton]- Arĝenta klorido estas facile sintezebla per kombinado en akva solvaĵo de arĝenta nitrato kaj natria klorido:
- Metodo de Rammelsbeerg: Kuproza klorido dissolviĝas en salaj solvaĵoj kaj reakcias kun arĝenta sulfido donante arĝentan kloridon, kuprikan sulfidon kaj metala kupro, laŭ la ekvacio:
- Arĝenta sulfido reakcias kun natria klorido en ĉeesto de oksigeno por doni arĝentan kloridon kaj natrian sulfaton.
- Arĝenta klorido sintezeblas per elektrokemia agado de la klorida acido sur arĝento:
\mathrm{: \ 2 \ Ag + 2 \ HCl \longrightarrow 2 \ AgCl + H_2}
Reakcioj
[redakti | redakti fonton]- Arĝenta klorido malkomponiĝas en acida medio en ĉeesto de zinko kaj sulfata acido:[5]
- Arĝenta klorido reakcias kun NH3 por doni amoniakan kompleksaĵon konatan kiel arĝenta-duaminan kloridon:
- Reduktado de la arĝenta klorido kun hidrazino:[6]
Literaturo
[redakti | redakti fonton]- Methods in Plant Cell Biology, David W. Galbraith, Hans J. Bohnert, Don P. Bourque
- Vacuum Sealing Techniques, Alexander Roth
- Remington: The Science and Practice of Pharmacy, David B. Troy, Paul Beringer
- Handbook of Pharmaceutical Controlled Release Technology, Donald L. Wise
- Biology: A Functional Approach. Students' Manual, M. B. V. Roberts, T. J. King
- General Chemistry, Enhanced Edition Darrell Ebbing, Steven D. Gammon
- Advances in Catalysis, Volume 2
Vidu ankaŭ
[redakti | redakti fonton]- Bromida acido
- Arĝenta nitrato
- Arĝenta bromido
- Kloroacetata acido
- Trikloroacetata acido
- Dukloroacetata acido
- Triklorofenokso-acetata acido
- Duklorofenokso-acetata acido
- Klorofenokso-acetata acido
Referencoj
[redakti | redakti fonton]- ↑ Chemical Book
- ↑ Carl Roth
- ↑ Chrystran. Arkivita el la originalo je 2017-04-16. Alirita 2017-06-18.
- ↑ PubChem
- ↑ Prudent Practices for Disposal of Chemicals from Laboratories
- ↑ Advances in Catalysis, Volume 2


