Amonia pikrato
| Amonia pikrato | ||||
| ||||
| Kemia strukturo de la Amonia pikrato | ||||

| ||||
| 3D Kemia strukturo de la Amonia pikrato | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Aspekto | Flavaj aŭ ruĝaj kristaloj | |||
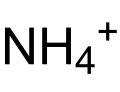
| Kemia formulo | ||||
| CAS-numero-kodo | 131-74-8 | |||
| PubChem-kodo | 8577 | |||
| ChemSpider kodo | 8259 | |||
| Fizikaj proprecoj | ||||
| Molmaso | 246.14 g•mol−1 g mol−1 | |||
| Smiles | C1=C(C=C(C(=C1[N+] (=O)[O-])[O-])[N+](=O)[O-]) [N+](=O)[O-].[NH4+] | |||
| Denseco | 1.719[1] g/cm3 | |||
| Fandopunkto | 265 °C (509 ℉; 538 K) | |||
| Solvebleco | Akvo:10 g/L (20 °C) | |||
| Sekurecaj Indikoj | ||||
| Risko | R3 R23/24/25 | |||
| Sekureco | S(S1/2) S28 S35 S37 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H201, H315, H317, H319, H402, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P210, P230, P240, P250, P261, P264, P270, P272, P273, P280, P302, P302+352, P305+351+338, P301+312, P332+313, P333+313, P337+313, P362, P363, P370+380, P372, P373, P501 | |||
(25 °C kaj 100 kPa) | ||||
Amonia pikrato, pikrato de amonio aŭ C6H2O(NO2)3NH4 estas eksplodema salo rezultanta el kompleta neŭtraliga reakcio inter la "pikrata acido" kaj amonia hidroksido. Kemie ĝi rilatas al la pli stabila eksplodaĵo trinitro-tolueno.
Ĝi estas la unua eksplodaĵo uzita en aerbombada operacio de la milita historio, plenumita de italaj pilotoj en Libio, en 1911. Ĝi estis grande uzata de la Usona Mararmeo dum la 1-a Mondmilito. Kvankam amonia pikrato estis ordinare konsiderata nesensiva substanco, ĉirkaŭ 1911 la Usona Armeo forlasis ĝian uzon favore de aliaj alternativoj.
Tamen, la Usona Mararmeo plu uzis ĝin en kirasdetrua artilerio kaj fajrarmilaro por marborda defendo. Pikrato de amonio povas uziĝi kiel antaŭanto de la alte stabila eksplodaĵo TATB aŭ 1,3,5-TriAmino-2,4,6-Trinitrobenzeno, unue senhidratigante ĝin al pikramida formo (ligante ĝin al amonio el amina grupo anstataŭe de amonijono) sekvata de posta aminigo.
Sintezo
[redakti | redakti fonton]Amonia pikrato rezultas el kompleta neŭtraligo de "pikrata acido" kaj NH3 en varma akvo:
| Sintezo de amonia pikrato | |||||
 |

| ||||
Amonia pikrato estas malpli sensiva ol "pikrata acido" kaj posedas pli altan fandopunkto (fp 265 °C ĝis 271 °C).
Reakcio
[redakti | redakti fonton]Guanidina pikrato prepareblas el "guanidina nitrato" kaj amonia pikrato (fp 319 °C)
| Sintezo de guanidina pikrato | |||||||
 |
 |
 |

| ||||
Referencoj
[redakti | redakti fonton]Literaturo
[redakti | redakti fonton]- Cameo Chemicals
- Toxnet
- Military Explosives
- Explosive Effects and Applications, Jonas A. Zukas,William Walters
- High Energy Materials: Propellants, Explosives and Pyrotechnics, Jai Prakash Agrawal
- Evaluation of the Health Risk of Ordnance Disposal Waste in Drinking Water ..., Assembly of Life Sciences (U.S.). Subcommittee on Ordnance Disposal Waste, Lawrence Fishbein
| ||||||






