Indolo: Malsamoj inter versioj
| [kontrolita revizio] | [atendante kontrolon] |
Projekto:Kontrolu Vikipedion Ŝablono ne finiĝas Etikedo: redakto de fonto je 2017 |
→Kunrilataj kemiaĵoj: 1-methylindole.svg |
||
| (Unu meza versio de alia uzanto ne montriĝas) | |||
| Linio 182: | Linio 182: | ||
Beta-Carboline.svg|<center><big>'''β-Karbolino'''</big></center> |
Beta-Carboline.svg|<center><big>'''β-Karbolino'''</big></center> |
||
Indene.png|<center><big>'''[[Indeno]]'''</big></center> |
Indene.png|<center><big>'''[[Indeno]]'''</big></center> |
||
Isatine.svg|<center><big>'''Izatino'''</big></center> |
|||
</Gallery> |
</Gallery> |
||
<Gallery> |
<Gallery> |
||
1-methylindole. |
1-methylindole.svg|<center><big>'''Metil-[[indolo]]'''</big></center> |
||
Oxindole.svg|<center><big>'''Okso-Indolo'''</big></center> |
Oxindole.svg|<center><big>'''Okso-Indolo'''</big></center> |
||
Indol-3-ylacetic_acid.svg|<center><big>'''Aŭksino'''</big></center> |
Indol-3-ylacetic_acid.svg|<center><big>'''Aŭksino'''</big></center> |
||
Nuna versio ekde 13:16, 30 okt. 2024
| Indolo | ||||

| ||||
| Plata kemia strukturo de la Indolo | ||||

| ||||
| Tridimensia strukturo de la Indolo | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 120-72-9 | |||
| ChemSpider kodo | 776 | |||
| PubChem-kodo | 798 | |||
| Merck Index | 15,5003 | |||
| Fizikaj proprecoj | ||||
| Aspekto | blanka solido kun forta fekaĵodoro, lumsensiva | |||
| Molmaso | 117.15 g·mol-1 | |||
| Denseco | 1.1747 g cm−3 | |||
| Fandpunkto | 52-54 °C | |||
| Bolpunkto | 253-254 °C | |||
| Ekflama temperaturo | 121 °C | |||
| Solvebleco | Akvo:1.9 g/L (20 °C) 3.56 (25 °C) | |||
| Mortiga dozo (LD50) | 1000 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Risko | R21/22 R37/38 R41 R50/53 | |||
| Sekureco | S26 S36/37/39 S45 S60/61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj[1] | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H302, H311, H315, H318, H335, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P273, P280, P305+351+338, P312 | |||
(25 °C kaj 100 kPa) | ||||
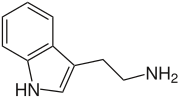
Indolo estas aromata organika heterocikla kombinaĵo kun ducikla strukturo, konsistante je sesmembra benzena ringo ligita al kvinmembra pirola ringo. Indolo estas vaste trovata en naturo tiaj kiaj en floroj de jasmeno kaj oranĝo kaj estas produktata de pluraj bakterioj kaj fekmaterialoj. Ĝi estas sintezebla de kelkaj bakterioj kiel malkomponiga produkto de la triptofana aminoacido.
Proprecoj
[redakti | redakti fonton]Ĝi nature troviĝas en homaj fekaĵoj kaj posedas intensan fekodoron. Ĉi-malagrabla odoro okazas en la biero pro malpurigo de koliformoj dum la primara staĝo je fermentado en la bierfabrikado. Tamen, en tre malaltaj koncentriĝoj ĝia odoro estas milda kaj agrabla kaj estas konstituanto de pluraj floresencoj kaj parfumoj. La natura jasmenoleo, uzada en parfumindustrio, enhavas ĉirkaŭ 2.5% da indolo.
Indolo ankaŭ okazas en la karbogudro. La partopreno de la elektrona paro en la nitrogena jono de la aromata ringo signifas ke la indolo ne estas bazo kaj ĝi ankaŭ ne kondutas sin kiel simpla amino. La aminoacido triptofano estas indola derivaĵo kaj antaŭanto de la nervotransigilo serotonino.
Historio
[redakti | redakti fonton]Indoloj estas gravaj antaŭaĵoj de aliaj substancoj en la homa korpo kaj do ili estas esplorataj kaj uzataj en medicino. La komponaĵo estis oficiale malkovrita en 1866 far sciencistoj laborantaj kun la proprecoj de la zinka pulvoro kiu reduktas la oksindolon al indolo.
Post la malkovro, la indoloj iĝis gravan konstituantoj de la tekstila industrio, kaj oni rimarkis ke ju pli esploroj estis faritaj, des pli la rolo de la indoloj plenumis en la homkorpa sistemo. La indolaj nukleoj en substancoj tiaj kiaj la triptofano kaj la aŭksino rezultis en pli bona kompreno de iliaj mekanismoj ene de la korpo.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- La sintezo por la indolo kreita de Emil Fischer (1877-1947) estas kemia reakcio kiu produktas aromatan heterociklan indolon ekde la fenil-hidrazino kaj aldehido aŭ ketono sub acidaj kondiĉoj. La reakcio estis malkovrita en 1883 kaj nuntempe antimigrenaj drogoj de la triptamina klaso ofte estas sintezitaj de tiu metodo.

Sintezo 2
[redakti | redakti fonton]- En 1893, August Bischler (1865-1957) kaj Richard Möhlau (1857-1940) kreis sintezon de la 2-aril-indolo ekde la α-bromo-acetofenono kun troo da anilino:

Sintezo 3
[redakti | redakti fonton]- Paul Gassman (1935-1993) kreis metodon por sintezado de la indolo per serio da kemiaj reakcioj uzantaj la anilinon kaj iu ketono:

Sintezo 4
[redakti | redakti fonton]- Sintezo de Larock: En 1991, Richard C. Larock, en la Iowa Ŝtata Universitato, raportis sian sintezon de la indolo ekde o-jodo-anilinoj kaj alkino duanstataŭita:

Sintezo 5
[redakti | redakti fonton]- Sintezo de Adolph Emmerling (1842-1906) kaj Adolf von Baeyer: Ĉi-metodo estis malkovrita en 1869 kaj uzas o-nitrocinamatan acidon kaj ferpulvoron en medio de forte baza solvaĵo:

Sintezo 6
[redakti | redakti fonton]- La Enterobacteriacea aŭ enterobakterioj kiuj posedas la enzimon triptofanazo povas uzi la triptofanon per senaminigo[2] kaj hidroliza forigo de la indola flankĉeno. La libera indolo detektiĝas per traktado kun p-dumetilamina-benzaldehido, kies aldehida grupo reakcias kun la indolo formante ruĝkoloran kompleksaĵon. La produktado de indolo ekde la triptofano estas grava biokemia propreco de pluraj bakterioj, inter ili Escherichia coli, Shigella, Edwardsiella tarda, Klebsiella oxytoca kaj Proteus vulgaris.

aŭ sintezo de la indolo per biologia malkomponado de la triptofano.
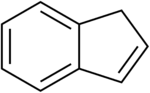
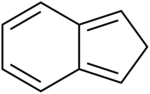
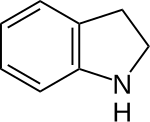
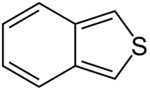
| Derivaĵoj de la indano | ||||||||
 |
 |
 |
 |
 | ||||
|
|
||||||||

|

|
|

|

| ||||
|
|
||||||||
 |
|

|

|
 | ||||
|
|
||||||||
Literaturo
[redakti | redakti fonton]- Chemical Book
- Chemicalland21
- Indoles, Richard J. Sundberg
- The Chemistry of Heterocyclic Compounds, Indole and Carbazole Systems, W. C. Sumpter, F. M. Miller
- Indole Ring Synthesis: From Natural Products to Drug Discovery, Gordon W. Gribble
- Indole Alkaloids: An Introduction to the Enamine Chemistry of Natural Products, W. I. Taylor
- Novel Indole Derivatives as CNS acting agents, Dr Swathi Konda
- The Chemistry of Indoles, Richard Sundberg
- The Alkaloids, Volumes 1-8, J. E. Saxton
- High Performance Liquid Chromatography in Phytochemical Analysis, Monika Waksmundzka-Hajnos, Joseph Sherma
- Encyclopedia of Microbiology, Four-Volume Set, Martin Alexander, Barry R. Bloom, David A. Hopwood, Roger Hull, Barbara H. Iglewski, Allen I. Laskin, Stephen G. Oliver, Moselio Schaechter, William C. Summers
Kunrilataj kemiaĵoj
[redakti | redakti fonton]-
β-Karbolino -
Izatino
-
Metil-indolo -
Okso-Indolo -
Aŭksino
Vidu ankaŭ
[redakti | redakti fonton]- Pirolo
- Indigo
- Triptofano
- Antranilata acido
- Adolf von Baeyer (1835-1917)
- Hermann Emil Fischer (1852-1919)
Referencoj
[redakti | redakti fonton]- ↑ Sigma Aldrich
- ↑ Senaminigo Arkivigite je 2017-04-20 per la retarkivo Wayback Machine estas forigo de la funkcia grupo amino.