Tupanvirus
Tupanvirus (TPV)[5] ist eine im April 2023 vom International Committee on Taxonomy of Viruses (ICTV) offiziell bestätigte Gattung von Riesenviren mit zwei Spezies, Tupanvirus altamarinense (Tupanvirus Deep Ocean, TupanDO) und Tupanvirus salinum (Tupanvirus Soda Lake, TupanSL).[1][2][6][7] Sie sind benannt nach Tupã (Tupan), einem Donnergott der Guaraní, und den Orten, an denen sie gefunden wurden. Einzigartig an diesen Viren ist, dass sie alle 20 Standardaminosäuren inkorporieren (oder übersetzen) können.[8][9][10]
| Tupanvirus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
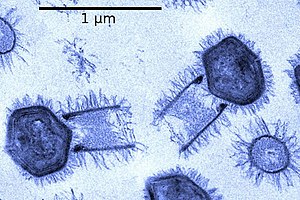
Tupanvirus sp. | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Tupanvirus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| TPV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Aufbau
BearbeitenDie Virionen (Virusteilchen) der Tupanviren haben eine Länge von bis zu 1,2 µm, wobei das Kapsid in Größe und Struktur ähnlich ist wie bei der Gattung Mimivirus. Die Virionen der Gattung Tupanvirus weisen jedoch einen großen zylindrischen Schwanz auf (~ 550 nm × 450 nm im Durchmesser), der an der Basis des Kapsids befestigt ist.[9] Einige Partikel können aufgrund der Variation der Größe dieses Schwanzes bis zu 2,3 µm erreichen.
Genom
BearbeitenDas Genom der Tupanviren besteht aus doppelsträngiger DNA. Bei Tupanvirus altamarinense (Tupanvirus deep ocean) hat es eine Länge von 1.516.267 bp (Basenpaaren) und kodiert vorhergesagt 1.359 Proteine, der GC-Gehalt liegt bei 29 %. Bei Tupanvirus salinum (Tupanvirus soda lake) sind es 1.439.508 bp Länge, 1.276 vorhergesagt kodierte Proteine, und gleicher GC-Gehalt.[12] Viele Gene, die Prozesse in zellulären Organismen vorkommen, werden auch in den Genomen der Gattung Tupanvirus gefunden.[9]
Replikation
BearbeitenDie Replikation findet – wie für Mitglieder der Familie Mimiviridae üblich – in einer Virusfabrik (en. viral factory, VF) statt.[11]
Wirte
BearbeitenTupanviren sind in der Lage, Protisten und Amöben zu infizieren, stellen jedoch keine Bedrohung für den Menschen dar.[8] Während die meisten Riesenviren nur in einer einzigen Spezies oder Gattung replizieren können, haben die Mitglieder der Gattung Tupanvirus ein sehr breites Wirtsspektrum, darunter Wirte der Gattung Acanthamoeba[13] (A. castellanii, A. polyphaga, A. griffini, A. sp. E4),.[14] sowie Vermamoeba vermiformis (Echinamoebida),[15][16][14][13] Willaertia magna (Vahlkampfiidae),[17][18][14][13] Tetrahymena hyperangularis und Dictyostelium discoideum.[14][13] Bei ihrer Entdeckung hatten die Tupanviren den größten Translationsapparat in der bekannten Virosphäre.[14] Die Analyse der Tupanviren ist daher ein wichtiger Schritt zum Verständnis der Evolution von Riesenviren.
Systematik
BearbeitenDie Gattung wurde im April 2023 vom International Committee on Taxonomy of Viruses (ICTV) mit den beiden Spezies offiziell anerkannt. Als Mitglied der Familie Mimiviridae, Gruppe I (Unterfamilie Megamimivirinae) gehört die Gattung Tupanvirus zum Phylum Nucleocytoviricota (früher Nucleocytoplasmic large DNA viruses, NCLDV).
Die Gattung Tupanvirus wird innerhalb der Mimiviridae-Gruppe I – ebenso wie die vorgeschlagene Gattung „Platanovirus“ (mit „Platanovirus saccamoebae“ KSL-5 und KSL-5x)[19][20] und dem möglicherweise nächsten Verwandten „Satyrvirus“[3] keiner der herkömmlichen Linien (Mimivirus/Linie A, Moumouvirus/Linie B oder Megavirus/Linie C) zugeordnet, sondern bildet mit diesen zusammen einer eigenen Linie (Tupanviren im weiteren Sinn).
Die folgende Systematik basiert auf der Master Species List #38 des International Committee on Taxonomy of Viruses (ICTV)[1][2] vom 8. April 2023
Familie Mimiviridae
- Klade (ehemals „Aquavirinae“, „Aquaviren“)[20][21]
- Unterfamilie Aliimimivirinae (Mimiviridae-Gruppe II)
- Gattung Rheavirus (früher Cafeteriavirus)
- Unterfamilie Klosneuvirinae (Klosneuviren)
- Gattungen Fadolivirus, Theiavirus (mit BsV), Yasminevirus
- Unterfamilie Aliimimivirinae (Mimiviridae-Gruppe II)
- Klade Mimiviridae-Gruppe I (Unterfamilie Megamimivirinae inklusive Gattung Mimivirus)
- Unterfamilie Megamimivirinae
- Gattung Mimivirus (Linie A)
- Gattung Moumouvirus (Linie B)
- Gattung Megavirus (Linie C)
- Gattung Cotonvirus (nahe Linie A?)
- Gattung Tupanvirus (TPV)
- Spezies Tupanvirus altamarinense mit Tupanvirus deep ocean (TupanDO)
- Spezies Tupanvirus salinum mit Tupanvirus soda lake (TupanSL)
- Gattung „Platanovirus“
- Gattung „Satyrvirus“[3]
- Unterfamilie Megamimivirinae
Habitat / Fundort
BearbeitenTupanSL ist ein Isolat aus einem brasilianischen Natronsee im Pantanal, TupanDO stammt aus Tiefsee-Bodensedimenten aus 3.000 m Tiefe (bei Campos dos Goytacazes).[13]
Kladogramme
BearbeitenFür den phylogenetischen Baum innerhalb der Familie Mimiviridae-Gruppe I gibt es verschiedene Vorschläge:
Kladogramm A
| Mimiviridae-Gruppe I |
| ||||||||||||||||||||||||||||||||||||
Diese Phylogenie entspricht dem Vorschlag von David Needham, Alexandra Worden et al. (2019), Fig. 2 und S3,[22] wonach die Stellung der Tupanviren basal innerhalb der Mimiviridae-Gruppe I ist (abgesehen vom unbestätigten „GVMAG-S-1014582-52“).
Nach Schulz et al. (2018), Fig. 2:[3] clustern die Tupanviren mit einer aus den Linien B und C gebildeten Klade:
Kladogramm B
| Mimiviridae-Gruppe I |
| ||||||||||||||||||||||||
Dies ist in Übereinstimmung mit Disa Bäckström et al. (2018) Fig. 3,[23] Koonin und Yutin (2018) Fig. 1[24] und Guglielmini et al. (2019), Fig. 2;[25] sowie in Übereinstimmung mit Abrahão al. (2018) Fig. 4,[9] aber in Fig. 3b derselben Arbeit(!) bilden die Tupanviren eine Schwestergruppe zur Gattung Mimivirus (Linie A):
Kladogramm C
| Mimiviridae-Gruppe I |
| ||||||||||||||||||
In diesem letzten Szenario könnten die Tupanviren ein Subset der Gattung Mimivirus darstellen.[26]
Bereits aufgrund der vor April 2023 vorliegenden Arbeiten konnte das erste Kladogramm A als wahrscheinlichstes Szenario für die phylogenetischen Beziehungen unter den Vertretern und Kandidaten der Mimiviridae-Gruppe I betrachtet werden. Das ICTV hat diese Sicht im April 2023 bestätigt (mit Ausnahme der Unterfamilien-Klassifizierug von Mimivirus). Die Tupanvirus-Gruppe wäre lediglich um „Satyrvirus“ und „Platanovirus“ (deren nächste Verwandten vermutlich die Tupanviren sind[27]) zu ergänzen.
Virophagen
BearbeitenSowohl Tupanvirus DO als auch Tupanvirus SL können für beide Virophagen Sputnik und Zamilon (Familie Sputniviroviridae der Klasse Maveriviricetes) als viraler Wirt dienen – zusammen mit Acanthamoeba castellanii als zellulärem Wirt. Der Wildtyp des Guarani Virophagen[A. 1] kann sich jedoch mit keinem der beiden Tupanvirus-Varianten und A. castellanii als zellulärem Wirt replizieren. Said Mougari et al. gelang es jedoch 2020, eine Mutante des Guarani-Virophagen zu selektieren, die Tupanviren infizieren kann. [30] Die Autoren vermuteten, dass ein kleiner Teil der Guarani-Virophagen-Population aus eben dieser Mutante bestand. Die Mutanten zeigten eine Veränderung (Deletion von 81 Nukleotiden) in ihrem kollagen-artigen Gen.[29]
Weblinks
Bearbeiten- Nicoletta Lanese: Giant viruses spew their DNA through a 'stargate.' Now, scientists know what triggers them. LiveScience, 26. Mai 2020
- Rodrigo Araújo Lima Rodrigues, Lorena Christine Ferreira da Silva, Jônatas Santos Abrahão: Translating the language of giants: translation-related genes as a major contribution of giant viruses to the virosphere. In: Archives of Virology, 165, Nr. 6, S. 1267–1278, 24. April 2020; doi:10.1007/s00705-020-04626-2, insbes. Fig. 2 (Großaufnahme)
- Khalil Geballa-Koukoulas, Bernard La Scola, Guillaume Blanc, Julien Andreani: Diversity of Giant Viruses Infecting Vermamoeba vermiformis. In: Frontiers in Microbiology, Band 13, 22. April 2022, S. 808499; doi:10.3389/fmicb.2022.808499 , PMID 35602053, PMC 9116030 (freier Volltext), PDF.
Anmerkungen
Bearbeiten- ↑ Der Guarani-Virophage wurde aus dem Pampulha-See in Brasilien isoliert. Er repliziert normalerweise mit Mimivirus bradfordmassiliense (ApMV). Dieser Virophage ist ebenfalls ein Mitglied der Maveriviricetes, mit Stand 30. April 2024 allerdings noch offiziell bestätigt.[11][28]
Einzelnachweise
Bearbeiten- ↑ a b c d e ICTV: Master Species Lists § ICTV Master Species List 2022 MSL38 v1 (xlsx), 8. April 2023.
- ↑ a b c d e Frank O. Aylward, Jônatas S. Abrahão, Corina P. D. Brussaard C, Matthias G. Fischer, Mohammad Moniruzzaman, Hiroyuki Ogata, Curtis A. Suttle: Create 3 new families, 3 subfamilies, 13 genera, and 20 new species within the order Imitervirales (phylum Nucleocytoviricota) and rename two existing species (zip:docx). Vorschlag 2022.004F an das ICTV vom Oktober 2021.
- ↑ a b c d Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses. In: Nature Communications, Band 9, Nr 4881, 19. November 2018; doi:10.1038/s41467-018-07335-2.
- ↑ a b c d e ICTV: ICTV Taxonomy history: Acanthamoeba polyphaga mimivirus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ Gabriel Augusto Pires de Souza, Victória Fulgêncio Queiroz, Maurício Teixeira Lima, Erik Vinicius de Sousa Reis, Luiz Felipe Leomil Coelho, Jônatas Santos Abrahão: Virus goes viral: an educational kit for virology classes. In: Virology Journal, Band 17, Nr. 13, 31. Januar 2020; doi:10.1186/s12985-020-1291-9.
- ↑ Jean-Michel Claverie, Chantal Abergel: Mimiviridae: An Expanding Family of Highly Diverse Large dsDNA Viruses Infecting a Wide Phylogenetic Range of Aquatic Eukaryotes. In: Viruses, Band 10, Nr. 9, September 2018, S. 506; doi:10.3390/v10090506, PMC 6163669 (freier Volltext), PMID 30231528.
- ↑
Jason R. Schrad, Jônatas S. Abrahão, Juliana R. Cortines, Kristin N. Parent: Structural and Proteomic Characterization of the Initiation of Giant Virus Infection. In: Cell, 8. Mai 2020; doi:10.1016/j.cell.2020.04.032, PDF. Dazu:
- Mysterious Giant Viruses: Gargantuan in Size and Complexity, auf: SciTechDaily vom 9. Mai 2020, Quelle: Michigan State University.
- ↑ a b Dan Garisto: These giant viruses have more protein-making gear than any known virus. 27. Februar 2018 (englisch).
- ↑ a b c d
Jônatas Abrahão, Lorena Silva, Ludmila Santos Silva, Jacques Yaacoub Bou Khalil, Rodrigo Rodrigues, Thalita Arantes, Felipe Assis, Paulo Boratto, Miguel Andrade, Erna Geessien Kroon, Bergmann Ribeiro, Ivan Bergier, Herve Seligmann, Eric Ghigo, Philippe Colson, Anthony Levasseur, Guido Kroemer, Didier Raoult, Bernard La Scola: Tailed giant Tupanvirus possesses the most complete translational apparatus of the known virosphere. In: Nature Communications. 9. Jahrgang, Nr. 1, 27. Februar 2018, doi:10.1038/s41467-018-03168-1 (englisch, nature.com). Dazu:
- Image of the Day: Giant Virus – The Tupanvirus is named for the South American Guarani God of Thunder. Auf: The Scientist, 28. Februar 2018.
- ↑ Frederik Schulz, Natalya Yutin, Natalia N. Ivanova, Davi R. Ortega, Tae Kwon Lee, Julia Vierheilig, Holger Daims, Matthias Horn, Michael Wagner, Grant J. Jensen, Nikos C. Kyrpides, Eugene V. Koonin, Tanja Woyke: Giant viruses with an expanded complement of translation system components. In: Science. 356. Jahrgang, Nr. 6333, 7. April 2017, S. 82–85, doi:10.1126/science.aal4657, PMID 28386012 (englisch, sciencemag.org).
- ↑ a b c d Clara Rolland, Julien Andreani, Amina Cherif Louazani, Sarah Aherfi, Rania Francis, Rodrigo Rodrigues, Ludmila Santos Silva, Dehia Sahmi, Said Mougari, Nisrine Chelkha, Meriem Bekliz, Lorena Silva, Felipe Assis, Fábio Dornas, Jacques Yaacoub Bou Khalil, Isabelle Pagnier, Christelle Desnues, Anthony Levasseur, Philippe Colson, Jônatas Abrahão, Bernard La Scola: Discovery and Further Studies on Giant Viruses at the IHU Mediterranee Infection That Modified the Perception of the Virosphere. In: Viruses, 11(4), März/April 2019, pii: E312, doi:10.3390/v11040312, PMC 6520786 (freier Volltext), PMID 30935049.
- ↑ David M. Needham, Susumu Yoshizawa, Toshiaki Hosaka, Camille Poirier, Chang Jae Choi, Elisabeth Hehenberger, Nicholas A. T. Irwin, Susanne Wilken, Cheuk-Man Yung, Charles Bachy, Rika Kurihara, Yu Nakajima, Keiichi Kojima, Tomomi Kimura-Someya, Guy Leonard, Rex R. Malmstrom, Daniel R. Mende, Daniel K. Olson, Yuki Sudo, Sebastian Sudek, Thomas A. Richards, Edward F. DeLong, Patrick J. Keeling, Alyson E. Santoro, Mikako Shirouzu, Wataru Iwasaki, Alexandra Z. Worden: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators. In: PNAS, 23. September 2019, ISSN 0027-8424; doi:10.1073/pnas.1907517116, inklusive Supplement 1 (xlsx).
- ↑ a b c d e Khalil Geballa-Koukoulas, Bernard La Scola, Guillaume Blanc, Julien Andreani: Diversity of Giant Viruses Infecting Vermamoeba vermiformis. In: Frontiers in Microbiology, Band 13, 22. April 2022, S. 808499; doi:10.3389/fmicb.2022.808499 , PMID 35602053, PMC 9116030 (freier Volltext), PDF.
- ↑ a b c d e
Graziele Oliveira, Bernard La Scola, Jônatas Abrahão: Giant virus vs amoeba: fight for supremacy. In: Virol J, Band 16, Nr. 126, 4. November 2019; doi:10.1186/s12985-019-1244-3, PDF. Siehe insbes. Fig. 2.
Anm.: Der Gattungsname Willaertia ist als Willartia verschrienben; der Gattungsname Dictyostelium ist als Dyctiostelium verschrieben. - ↑ NCBI Taxonomy Browser: Vermamoeba, Details: Vermamoeba (genus).
- ↑
WoRMS: VermamoebaSmirnov et al., 2011 (Genus). Environment: fresh, terrestrial.
Anm.: Bitte die Schalter „marine only“ und ggf. „extant only“ ausschalten. - ↑ NCBI Taxonomy Browser: Willaertia, Details: Willaertia (genus).
- ↑
WoRMS: Willaertia De Jonckheere, Dive, Pussard & Vickerman (Genus). Environment: fresh, terrestrial.
Anm.: Bitte die Schalter „marine only“ und ggf. „extant only“ ausschalten. - ↑ a b Bärbel Hauröder, Liane Junglas, Silke Loch, Rolf Michel, Karl-Dieter Müller, Claudia Wylezich: Experimental co-infection of Saccamoeba lacustris with Mimivirus-like Giant virus and a small Satellite virus. In: Endocytobiosis and Cell Research, Band 29, 15. Mai 2018; ResearchGate, Open Agrar.
- ↑ a b c List of the main “giant” viruses known as of today. (PDF) Centre national de la recherche scientifique, Université d’Aix-Marseille, 18. April 2018.
- ↑ List of the main “giant” viruses known as of today. (PDF) Centre national de la recherche scientifique, Université d’Aix-Marseille, März 2019.
- ↑ David M. Needham, Susumu Yoshizawa, Toshiaki Hosaka, Camille Poirier, Chang Jae Choi, Elisabeth Hehenberger, Nicholas A. T. Irwin, Susanne Wilken, Cheuk-Man Yung, Charles Bachy, Rika Kurihara, Yu Nakajima, Keiichi Kojima, Tomomi Kimura-Someya, Guy Leonard, Rex R. Malmstrom, Daniel R. Mende, Daniel K. Olson, Yuki Sudo, Sebastian Sudek, Thomas A. Richards, Edward F. DeLong, Patrick J. Keeling, Alyson E. Santoro, Mikako Shirouzu, Wataru Iwasaki, Alexandra Z. Worden: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators. In: PNAS, 23. September 2019; doi:10.1073/pnas.1907517116, ISSN 0027-8424, PDF (PDF) inklusive Supplement 1. (xlsx)
- ↑ Disa Bäckström, Natalya Yutin, Steffen L. Jørgensen, Jennah Dharamshi, Felix Homa, Katarzyna Zaremba-Niedwiedzka, Anja Spang, Yuri I. Wolf, Eugene V. Koonin, Thijs J. G. Ettema: Virus Genomes from Deep Sea Sediments Expand the Ocean Megavirome and Support Independent Origins of Viral Gigantism. In: mBio, 2018/2019; doi:10.1128/mBio.02497-18, PMID 30837339.
- ↑ Eugene V. Koonin, Natalya Yutin: Multiple evolutionary origins of giant viruses. In: F1000 Research, 22. November 2018; doi:10.12688/f1000research.16248.1, version 1.
- ↑
Julien Guglielmini, Anthony C. Woo, Mart Krupovic, Patrick Forterre, Morgan Gaia: Diversification of giant and large eukaryotic dsDNnA viruses predated the origin of modern eukaryotes. In: PNAS, Band 116, Nr. 39, 10./24. September 2019, S. 19585–19592, doi:10.1073/pnas.1912006116, PMID 31506349. Siehe insbes. Fig. 2. Dazu:
- Julien Guglielmini, Anthony Woo, Mart Krupovic, Patrick Forterre, Morgan Gaia: Diversification of giant and large eukaryotic dsDNA viruses predated the origin of modern eukaryotes. bioRxiv, 29. Oktober 2018, bioRxiv: 10.1101/455816v1 (Preprint-Volltext), doi:10.1101/455816 (PrePrint).
- ↑ Sailen Barik: A Family of Novel Cyclophilins, Conserved in the Mimivirus Genus of the Giant DNA Viruses, in: Computational and Structural Biotechnology Journal, Band 16, Juli 2018, S. 231–236, doi:10.1016/j.csbj.2018.07.001.
- ↑ Claudia Wylezich, Bärbel Hauröder, Dirk Höper, Martin Beer: A new giant virus isolated from its natural host Saccamoeba sp. together with its virophage shows a narrow host range. In: Conference: 38th meeting of the german Society for Protozoology (DGP), At Vienna/Austria, Februar 2019; ResearchGate.
- ↑ Said Mougari, Meriem Bekliz, Jonatas Abrahao, Fabrizio Di Pinto, Anthony Levasseur, Bernard La Scola: Guarani Virophage, a New Sputnik-Like Isolate From a Brazilian Lake. In: Frontiers in Microbiology. Band 10, 3. Mai 2019, ISSN 1664-302X, doi:10.3389/fmicb.2019.01003, PMID 31130943, PMC 6510173 (freier Volltext). – (Volltext als PDF Auf: semanticscholar.orgPDF)
- ↑ a b Said Mougari, Nisrine Chelkha, Dehia Sahmi-Bounsiar, Fabrizio Di Pinto, Philippe Colson, Jonatas Abrahao, Bernard La Scola: A virophage cross-species infection through mutant selection represses giant virus propagation, promoting host cell survival. In: Nature Communications Biology, Band 3, Nr. 248, 21. Mai 2020; doi:10.1038/s42003-020-0970-9 (englisch). Siehe insbes. Zugriffsnummern unter §Data avaibility.
- ↑ NCBI Taxonomy Browser: Guarani virus und Nucleotide: Guarani virus isolate Tupan …. Zugriffsnummer: MT179725.
Anm.: Gemeint ist hier die Tupanvirus-Mutante des Guarani-Virophagen, im Gegensatz zum Wildtyp, der die Zugriffsnr. LS999520 hat. Siehe Mougare et al. (2020) §Data avaibility.[29]