Balmer-Serie

Als Balmer-Serie wird eine bestimmte Folge von Spektrallinien im sichtbaren elektromagnetischen Spektrum des Wasserstoffatoms bezeichnet, deren unteres Energieniveau in der L-Schale liegt. Sie wird beim Übergang eines Elektrons von einem höheren zum zweittiefsten Energieniveau emittiert.
Weitere nach ihren Entdeckern benannte Serien sind die Lyman-, Paschen-, Brackett-, Pfund- und die Humphreys-Serie.
Die Linien im Wasserstoff-Spektrum
[Bearbeiten | Quelltext bearbeiten]Die Spektrallinien der Balmer-Serie sind nach dem Schweizer Physiker Johann Jakob Balmer benannt, der 1885 die dahinterliegende Bildungs-Gesetzmäßigkeit, die Balmer-Formel, erkannte.
Die Spektrallinien treten sowohl als Absorptionslinien (z. B. im Sonnenlicht durch Durchgang durch die Sonnenatmosphäre) wie auch als Emissionslinien
einer Wasserstoff-Gasentladungslampe (häufig als Balmerlampe oder -röhre bezeichnet) auf.
Entdeckung im Jahr 1885
[Bearbeiten | Quelltext bearbeiten]Im sichtbaren Bereich des Wasserstoffatom-Spektrums lassen sich vier Linien beobachten, deren Abstände voneinander mit abnehmender Wellenlänge kleiner werden. Sie werden, beginnend mit der größten Wellenlänge, als H‑α (H‑alpha), H‑β, H‑γ und H‑δ bezeichnet. Ihre Wellenlängen (in Luft) lassen sich mit der Balmer-Formel berechnen:
ist dabei eine damals empirisch bestimmte Konstante, die Balmer mit , einer Wellenlänge im Ultravioletten, angab[1]. Für sind die ganzen Zahlen 3, 4, 5 und 6 einzusetzen. Dabei ist die Nummer der Schale bzw. die Hauptquantenzahl des höheren, die die des tieferen Zustandes.
Im fürs menschliche Auge nicht sichtbaren ultravioletten Bereich des Spektrums waren damals schon fünf weitere Linien bekannt, die aber erstmals von Balmer als Linien des Wasserstoffs erkannt und fortlaufend mit H‑ε, H‑ζ, H‑η, H‑ϑ und H‑ι bezeichnet wurden. Deren Wellenlängen lassen sich mit ganzzahligen oberhalb 6 ebenfalls sehr gut berechnen.
Die folgende Tabelle enthält Balmer bekannte Wellenlängen (kursiv), die aktuellen Daten der NIST-Datenbank sowie aus der Rydberg-Konstante berechnete Wellenlängen unter Berücksichtigung der endlichen Masse des Atomkerns. sind dabei Wellenlängen in Luft ( = 1,000 28), sind Vakuumwellenlängen.
Die Folge konvergiert für wachsende von oben gegen die Wellenlänge , dem H-Grenzwert bzw. H-Limit.
| Name der Linie / nach Fraunh. | H‑α / C | H‑β / F | H‑γ / G' | H‑δ / h | H‑ε | H‑ζ | H‑η | H‑ϑ | H‑ι | H‑Limit | |
| Farbe | rot | türkis | indigo | violett | violett | violett | violett | ultraviolett | ultraviolett | ultraviolett | |
| Sichtbarkeit fürs menschl. Auge | gut sichtbar | schlecht sichtbar | unsichtbar | ||||||||
| Übergang von | 2 → 3 | 2 → 4 | 2 → 5 | 2 → 6 | 2 → 7 | 2 → 8 | 2 → 9 | 2 → 10 | 2 → 11 | 2 → | |
| Wellenlänge λ' in Luft (nm) |
A. J. Ångström (1862)[2] | 656,210 | 486,074 | 434,01 | 410,12 | ||||||
| H. W. Vogel (1879)[3][4] | 396,9 | 388,7 | 383,4 | 379,5 | 376,9 | ||||||
| Sir W. Huggins (1880)[5] | 396,8 | 388,75 | 383,4 | 379,6 | 376,75 | ||||||
| gemessen: NIST[6] | 656,279 | 486,1350 | 434,0472 | 410,1734 | 397,0075 | 388,9064 | 383,5397 | 379,7909 | 377,0633 | 364,5989 | |
| berechnet: Protium | 656,2858 | 486,1377 | 434,0515 | 410,1787 | 397,0124 | 388,9101 | 383,5437 | 379,7950 | 377,0683 | 364,6032 | |
| berechnet: Deuterium | 656,1073 | 485,0054 | 433,9334 | 410,0671 | 396,9044 | 388,8043 | 383,4393 | 379,6917 | 376,9657 | 364,5041 | |
| berechnet: Tritium | 656,0479 | 485,9614 | 433,8941 | 410,0300 | 396,8685 | 388,7692 | 383,4046 | 379,6574 | 376,9316 | 364,4711 | |
| Vakuum- Wellenlänge λ (nm) |
gemessen: NIST | 656,4628 | 486,2711 | 434,1687 | 410,2882 | 397,1187 | 389,0153 | 383,6471 | 379,8972 | 377,1689 | 364,7010 |
| berechnet: Protium | 656,4696 | 486,2738 | 434,1730 | 410,2935 | 397,1236 | 389,0190 | 383,6511 | 379,9014 | 377,1739 | 364,7053 | |
| berechnet: Deuterium | 656,2910 | 486,1415 | 434,0549 | 410,1819 | 397,0156 | 388,9132 | 383,5467 | 379,7980 | 377,0713 | 364,6061 | |
| berechnet: Tritium | 656,2316 | 486,0975 | 434,0156 | 410,1448 | 396,9796 | 388,8780 | 383,5120 | 379,7637 | 377,0372 | 364,5731 | |
Die Verwendung von Deuterium spielt hierbei eine nicht nur akademische Rolle. Auf Grund der geringeren Reaktivität von Deuterium (gegenüber leichtem Wasserstoff) wird es häufig in Deuterium-Lampen eingesetzt, die eine vielfach längere Betriebsdauer bei höherem Lichtstrom haben.[7]
Verallgemeinerung durch Rydberg im Jahr 1888
[Bearbeiten | Quelltext bearbeiten]Verallgemeinerung für Wasserstoff
[Bearbeiten | Quelltext bearbeiten]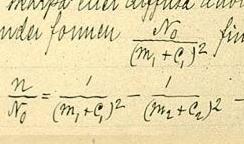
Ersetzt man in der Balmer-Formel , so erhält man
- .
Durch Umstellen der Wellenlänge nach der Wellenzahl erhält man
- ,
in der die korrigierte Rydberg-Konstante ist, die sowohl den Rückstoß für leichte Wasserstoff-Kerne ( und sind die Massen von Proton und Elektron; kostet Energie, verlängert die Wellenlänge um deren Massenverhältnis von 1/1836,15) wie den Brechungsindex für Luft berücksichtigt ( = 1,000 28, verkürzt die Wellenlänge um etwa 280 ppm).
Die nach dem schwedischen Physiker Johannes Rydberg benannte Rydberg-Konstante selbst berechnet sich aus der Masse des Elektrons , der Lichtgeschwindigkeit , der Planck-Konstante , der Elementarladung und der elektrischen Feldkonstante zu
- .
Im Jahr 1888, d. h. bereits drei Jahre nach Balmers Entdeckung, erkannte J. Rydberg dies und verallgemeinerte Balmers' Formel durch Ersetzen der durch ebenfalls einen Index zu der nach ihm benannten Rydberg-Formel:[8]
mit
- der Hauptquantenzahl des Ausgangszustandes und
- der Hauptquantenzahl des Endzustands.
Bis zu diesem Zeitpunkt allerdings waren im Wasserstoffspektrum nur die sichtbaren Linien für bekannt, womit Rydbergs Gleichung auch eine Vorhersage noch zu entdeckender Linien war. Die Entdeckung der im ultravioletten Bereich liegenden Lyman-Serie für durch den US-amerikanischen Physiker Theodore Lyman im Jahr 1906 sowie der im infraroten Bereich liegenden Paschen-Serie für durch den deutschen Physiker Friedrich Paschen im Jahr 1908 bestätigten jedoch schon bald die Richtigkeit von Rydbergs Erweiterung.
Verallgemeinerung für weitere Elemente
[Bearbeiten | Quelltext bearbeiten]Die Erweiterung Balmers Formel durch Rydberg beinhaltete nicht durch die Vorhersage weiterer Serien des Wasserstoffspektrum (das ist nur eine Randnotiz auf Seite 42 des 160-seitigen Dokuments), sondern die empirische Erweiterung für 19 weitere Elemente durch
- .
und stellen hierbei empirisch bestimmte, elementabhängige Korrektur-Konstanten dar.
| Variablenname für | Artikel | |
|---|---|---|
| tieferes Niveau |
höheres Niveau | |
| = 2 | Balmer (1885) | |
| Rydberg (1888) | ||
| Rydberg (1890) | ||
| = 2 | dieser Artikel | |
| 1 ... 6 | Artikel und verwendete Diagramme (Lyman, ...) | |
| Artikel Rydberg-Formel | ||
| Artikel Rydberg-Formel (spanisch) | ||
| Artikel Rydberg-Formel (niederl.) | ||
Variablennamen für die Hauptquantenzahlen
[Bearbeiten | Quelltext bearbeiten]Die verwendeten Variablennamen für das tiefere und höhere Energieniveau werden sehr uneinheitlich gehandhabt. Teilweise wechseln sie innerhalb von Artikeln oder Text und Zeichnungen sind nicht konsistent zueinander. Man sollte sich dadurch nicht verwirren lassen und sich klarmachen, was in dem Artikel gerade die „kleinere“ Zahl / tiefere Niveau und was die „größere“ Zahl / höhere Niveau ist.
Grenzen und Korrekturen Balmers/Rydbergs Formel
[Bearbeiten | Quelltext bearbeiten]Rydbergs Konstante lässt sich aus fünf Elementarkonstanten berechnen und beschreibt die beobachteten Wellenlängen ziemlich genau. Allerdings treten geringe Abweichungen auf. Die ersten beiden lassen sich sehr einfach klassisch erklären, die anderen beiden sind quantenmechanische Effekte und führen zur Aufspaltung der Spektrallinien:
- endliche Masse des Atomkerns, für die drei Wasserstoff-Isotope lauten die Konstanten:
- für leichten Wasserstoff,
- für schweren Wasserstoff (Deuterium) und
- für überschweren Wasserstoff.
- Für ionisiertes Helium-4: .
- Ohne Berücksichtigung des Rückstoßes lautet die Konstante:
- .
- Beobachtung der Wellenlänge in einem refraktiven Medium (Luft) mit
- .
- Diese ersten beiden Effekte kompensieren sich teilweise, bei Deuterium und üblichen Laborbedingungen (20 °C) sogar ziemlich genau.
- Weitere (statische) Korrekturen durch quantenmechanische Wechselwirkungen zwischen Kern und Elektron, der zu einer (statischen) Erhöhung der Energiedifferenzen führt: Die Erhöhungen liegen zwischen 5,5 (H‑β) und 13,3 ppm (H‑ι).
- Feinstruktur-Aufspaltung der Energie-Niveaus bei Hauptquantenzahlen größer 1 entsprechend der Nebenquantenzahl
- So erfolgt der Übergang von 1s → 2s mit einer Wellenlänge von 121,56731 nm, der von 1s → 2p mit 121,56699 nm (2,6 ppm Unterschied).
- Hyperfeinstruktur-Aufspaltung: Wechselwirkungen zwischen Elektron und magnetischen (Dipol-) und elektrischen (Quadrupol-)Moment des Atomkerns. So ist das 1s-Energieniveau je nach Spin-Ausrichtung zwischen Elektron und Proton um 5,9 µeV unterschiedlich, was bei 1s → 2-Übergängen zu einer Aufspaltung um 0,57 ppm führt.
Ritzsches Kombinationsprinzip
[Bearbeiten | Quelltext bearbeiten]
Die Gleichung von Rydberg beschreibt viele Spektren recht genau.
Das Ritzsches Kombinationsprinzip, entdeckt im Jahr 1908 vom Schweizer Mathematiker Walter Ritz, berechnet keine Spektren, sondern macht nur Aussagen über weitere möglicherweise auftretende Spektrallinien.
- Durch additive oder subtraktive Kombination, sei es der Serienformeln selbst,
sei es der in sie eingehenden Konstanten, lassen sich andere Serienformeln bilden.
Physikalischer Hintergrund ist die energetische Kombination zweier (oder auch mehrerer) Übergänge. Betrachtet man nicht die Wellenlängen, sondern die Wellenzahlen oder Energien, dann ergänzen sich diese ideal.
Vereinfacht ausgedrückt bedeutet dies, dass sich aus zwei (oder mehr) bekannten Linien eine mögliche dritte Linie berechnen lässt. Jedoch lassen sich nicht alle dieser berechneten Linien beobachten. Welche Linien wirklich auftreten, konnte Ritz nicht erklären.
Hier spielen zwei unterschiedliche Dinge eine Rolle:
- Die emittierten Wellenlängen müssen aus gemeinsamen Energiezuständen heraus entstehen.
- Die Übergänge dürfen durch z. B. große Änderungen des Spins nicht „verboten“ (geringe Übergangswahrscheinlichkeiten) sein.
Additive Kombination Subtraktive Kombination Zustand Zustand Zustand Zustand Zustand Zustand
Beispiel sind die Linien der Balmer-Serie H‑α und H‑δ sowie die Paschen-Linie Pa‑γ.
Diese haben die Wellenlängen:
- 656 nm (1,89 eV),
- 410 nm (3,02 eV) und
- 1090 nm (1,13 eV).
Übrigens ist .
Additive Kombination Subtraktive Kombination Zustand Zustand Zustand Zustand Zustand Zustand
Deutung durch das Bohrsche Atommodell
[Bearbeiten | Quelltext bearbeiten]Die bis zu diesem Zeitpunkt rein empirisch gefundenen Formeln ließen sich erstmals mit dem Bohrschen Atommodell verstehen. Danach sind die Spektrallinien auf den Übergang von Elektronen auf ein anderes Energieniveau zurückzuführen. Mit dem Modell von Bohr erhält man als allgemeine Gleichung für diese Übergänge:
- .
Der erste Ausdruck in der Klammer, , ist der so genannte Grundterm. Der zweite, , wird als Laufterm bezeichnet. Hält man im Grundterm fest und variiert jeweils im Laufterm, so ergeben sich die unten aufgeführten, nach ihren Entdeckern benannten Serien. Mit Ausnahme von H‑α (rot), H‑β (türkis), H‑γ (indigo), H‑δ, H‑ε und H‑ζ (alle violett, zunehmend schlechter fürs Auge sichtbar) liegen sie im ultravioletten bzw. infraroten Bereich des Frequenzspektrums.
| Serie | Formel | Spektralbereich / Farbe | ||
|---|---|---|---|---|
| Lyman (1906) |
1 | 2, 3, 4, … | alle Linien im Bereich des Vakuum-UVs
121,5, 102,5, 97,2, 94,9, 93,7 nm, ... ⟶ 91,1 nm | |
| Balmer (1885) |
2 | 3, 4, 5, … | rot, türkis, indigo, 4× violett, Übergang zum nahen UV
656, 486, 434, 410, 397, 389, 383 nm, ... ⟶ 364 nm | |
| Paschen (1908) |
3 | 4, 5, 6, … | nahes Infrarot: IR-B, Übergang zu IR-A
1875, 1281, 1094, 1005, 954 nm, ... ⟶ 820 nm | |
| Brackett (1922) |
4 | 5, 6, 7, … | mittleres/nahes Infrarot: IR-C, Übergang zu IR-B
4050, 2624, 2165, 1944, 1816 nm, ... ⟶ 1458 nm | |
| Pfund (1924) |
5 | 6, 7, 8, … | mittleres/nahes Infrarot: IR-C, Übergang zu IR-B
7456, 4651, 3739, 3295, 3038 nm, ... ⟶ 2279 nm | |
| Humphreys (1953) |
6 | 7, 8, 9, … | mittleres Infrarot: IR-C
12365, 7498, 5905, 5126, 4670 nm, ... ⟶ 3281 nm | |
| Hansen, P. Strong, J. (1972)[9] |
7 | 8, 9, … | mittleres Infrarot: IR-C
19062, 11309, 8760, 7508, 6772 nm, ... ⟶ 4468 nm |
Bereits im Bohrschen Atommodell ist, im Gegensatz zur Balmerformel, die Konstante keine rein empirische Größe. Vielmehr lässt sich der Wert direkt auf in die Rechnung eingehende Naturkonstanten zurückführen. Auch die Einschränkung auf ganzzahlige Werte für und sowie die Bedingung folgen aus diesem Modell.
ist dabei die Hauptquantenzahl des angeregten Ausgangszustands und die des (weniger) angeregten Endzustands, für die des Grundzustands.
Die Abbildung ganz am Anfang des Artikels zeigt das Termschema des Wasserstoffatoms und visualisiert die obigen Gleichungen: auf der linken vertikalen Achse ist abgetragen. Auf der rechten vertikalen Achse ist die zugehörige Anregungsenergie, jeweils vom Grundzustand aus gemessen, in eV angegeben. Der Abstand der Energieniveaus ist maßstabsgerecht. In horizontaler Richtung sind für jede Serie exemplarisch die ersten Übergänge eingezeichnet. Die zugehörigen Hauptquantenzahlen des Zustandes sind darüber angegeben. Der Abstand der Linien zueinander, d. h. in horizontaler Richtung, ist nicht maßstabsgerecht, sondern aus Gründen der Übersichtlichkeit gleich groß gewählt. Die Abbildung verdeutlicht, dass alle Linien einer Serie auf dem gleichen Energieniveau enden. Die Hα-Linie der Balmer-Serie ist somit ein Übergang von = 3 nach = 2.
Ganz rechts in den Serien ist gepunktet die jeweilige Seriengrenze dargestellt, d. h.
- .
Das Elektron ist dann nicht mehr an dem Atomkern gebunden, das Atom ist ionisiert. Für die Lyman-Serie erhält man mit der Bohrschen Gleichung eine Energie von etwa 13,6 eV. Auch dieser Wert stimmt mit dem experimentell bestimmten Wert für die Ionisationsenergie des Wasserstoffatoms im Grundzustand gut überein.
Die Frage, welche der Linien, die nach dem Ritzschen Kombinationsprinzip möglich sind, auch tatsächlich auftreten, wird durch die Auswahlregeln geklärt. Diese ergeben sich aus quantenmechanischen Rechnungen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Der Entdecker Balmer untersuchte das von Gasentladungen in Wasserstoff ausgehende Licht, weil er vermutete, dass zwischen der Lichtemission und dem Aufbau der Atome ein ursächlicher Zusammenhang besteht. Das emittierte Licht, mit einem Gitter spektral zerlegt, zeigt die vier diskreten Linien im sichtbaren Bereich (Linienspektrum). Balmer fand 1884 das Bildungsgesetz (siehe oben) mit der Konstanten .
Er hielt seine Entdeckung für einen Spezialfall einer noch unbekannten allgemeineren Gleichung, die auch für andere Elemente gültig sein könnte. Diese Vermutung wird durch spätere Untersuchungen von Spektren von Atomen oder Ionen mit nur einem Elektron in der äußersten Schale bestätigt. Ungeklärt blieb für Balmer jedoch die physikalische Bedeutung von .
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Johann Jakob Balmer: Notiz über die Spectrallinien des Wasserstoffs. In: Wiedemann’s Annalen der Physik und Chemie 25 (1885), S. 80–87, auch zu finden als: Annalen der Physik, Band 261, Heft 5, 1885, S. 80–87 (Abgerufen am 1. November 2010)
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Verhandlungen der Naturforschenden Gesellschaft in Basel; Band 7; S. 552; Notiz über die Spektrallinien des Wasserstoffs, Von Dr. J. J. Balmer
- ↑ Ångström, Anders Jonas: Ueber die Fraunhofer'schen Linien im Sonnenspectrum. In: Annalen der Physik, Band 193, Ausgabe 10 (1862), Seiten 290 bis 302.
- ↑ Explaining Models: Theoretical and Phenomenological Models and their Role for the First Explanation of the Hydrogen Spectrum
- ↑ Vogel, Hermann Wilhelm: Über die neuen Wasserstofflinien und die Spectra der weissen Fixsterne. In: Astronomische Nachrichten, Band 96, Ausgabe 21 (1880), Seiten 327 bis 330.
- ↑ Huggins, William: „On the Photographic Spectra of Stars“. In: Philosophical Transactions of the Royal Society of London, Band 171 (1880), Seiten 669 bis 690.
- ↑ NIST Atomic Spectra Database Lines Data for Z = 1: Spalte 1: Observed Wavelength Air (nm)
- ↑ Gleiches gilt für aktuelle OLED-Displays, auch hier wird zunehmend leichter Wasserstoff durch Deuterium substituiert. Siehe Schweres Wasser gegen Einbrennen am OLED
- ↑ Rydberg, J. R. (1890). Recherches sur la constitution des spectres d'émission des éléments chimiques. (Kungliga vetenskapsakademiens handlingar; Vol. 23, No. 11). Kungliga Vetenskapsakademien., S. 42 (dt.: Untersuchungen über die Beschaffenheit der Emissionsspektren der chemischen Elemente : am 13. November 1889 der Kgl. Schwedischen Akademie der Wissenschaften überreichte Abhandlung / von J. R. Rydberg.)
- ↑ Peter Hansen, John Strong: Seventh Series of Atomic Hydrogen. In: Applied Optics. 12. Jahrgang, Nr. 2, 1973, S. 429–430, doi:10.1364/AO.12.000429, PMID 20125315, bibcode:1973ApOpt..12..429H.
