„Berylliumsulfat“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
+Herstellung |
K →Physikalische Eigenschaften: typo: ist Bindestrich |
||
| (39 dazwischenliegende Versionen von 27 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie |
{{Infobox Chemikalie |
||
| Strukturformel = [[Datei:Be2+.svg|33px|Berylliumion]] [[Datei:Sulfate.svg|80px|Sulfation]] |
|||
| Name = Berylliumsulfat |
|||
| ⚫ | |||
| Summenformel = * BeSO<sub>4</sub> (wasserfrei) |
|||
* BeSO<sub>4</sub>·4 H<sub>2</sub>O (Tetrahydrat) |
* BeSO<sub>4</sub>·4 H<sub>2</sub>O (Tetrahydrat) |
||
| CAS = * {{CASRN|13510-49-1}} (wasserfrei) |
|||
* 7787-56-6 (Tetrahydrat) |
* {{CASRN|7787-56-6|Q27124078}} (Tetrahydrat) |
||
| EG-Nummer = 236-842-2 |
|||
| ⚫ | |||
| ECHA-ID = 100.033.478 |
|||
| ⚫ | |||
| PubChem = 26077 |
|||
| ChemSpider = 24291 |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| Siedepunkt = |
|||
| Aggregat = fest |
|||
| Dichte = * 2,443 g·cm<sup>−3</sup> (wasserfrei)<ref name="GESTIS" /> |
|||
| ⚫ | |||
| ⚫ | |||
| Quelle GefStKz = {{RL|Sammelbegriff=Berylliumverbindungen|ZVG=82790|Datum=31. März 2009}} |
|||
| ⚫ | |||
| Gefahrensymbole = {{Gefahrensymbole|T+|N}} |
|||
| Siedepunkt = |
|||
| Dampfdruck = |
|||
| Löslichkeit = * sehr gut in Wasser (413 g·l<sup>−1</sup> bei 25 °C)<ref name="GESTIS" /> |
|||
| ⚫ | |||
| ⚫ | |||
| CLH = {{CLH-ECHA|Sammeleinstufung=ja|ID=100.240.756|Name=beryllium compounds with the exception of aluminium beryllium silicates, and with those specified elsewhere in this Annex|Abruf=2016-02-01}} |
|||
| Quelle GHS-Kz = <ref name="GESTIS">{{GESTIS|ZVG=126662 |CAS=13510-49-1 |Name=Berylliumsulfat |Abruf=2022-11-18}}</ref> |
|||
| GHS-Piktogramme = {{GHS-Piktogramme|06|08|09}} |
|||
| GHS-Signalwort = Gefahr |
|||
| H = {{H-Sätze|350i|330|301|372|319|335|315|317|411}} |
|||
| EUH = {{EUH-Sätze|-}} |
|||
| P = {{P-Sätze|201|260|280|301+310+330|304+340+310|308+313|403+233}} |
|||
| Quelle P = <ref name="Sigma" /> |
|||
| MAK = |
|||
| Standardbildungsenthalpie = −1205,2 kJ/mol<ref name="CRC90_5_6">{{CRC Handbook|Auflage=90|Titel=Standard Thermodynamic Properties of Chemical Substances|Kapitel=5|Startseite=6}}</ref> |
|||
| ToxDaten = {{ToxDaten|Typ=LD50 |Organismus=Ratte |Applikationsart=oral |Wert=82 mg·kg<sup>−1</sup>|Bezeichnung= |Quelle=<ref name="GESTIS" /> }} |
|||
}} |
}} |
||
'''Berylliumsulfat''' ist ein weißes [[Beryllium]]-[[Salze|Salz]] der [[Schwefelsäure]] mit der Summenformel BeSO<sub>4</sub>. |
'''Berylliumsulfat''' ist ein weißes [[Beryllium]]-[[Salze|Salz]] der [[Schwefelsäure]] mit der Summenformel BeSO<sub>4</sub>. |
||
Es wurde erstmals 1815 von [[Berzelius]] isoliert<ref name="Ch. L. Parsons"> |
Es wurde erstmals 1815 von [[Berzelius]] isoliert.<ref name="Ch. L. Parsons">Ch. L. Parsons: ''The Chemistry and Literature of Beryllium.'' London 1909, S. 33 ff.</ref> |
||
== Herstellung == |
== Herstellung == |
||
Berylliumsulfat kann durch Auflösung von [[Berylliumcarbonat]] oder [[Berylliumhydroxid]] in verdünnter Schwefelsäure gewonnen werden.<ref name="Levi"/> |
Berylliumsulfat kann durch Auflösung von [[Berylliumcarbonat]] oder [[Berylliumhydroxid]] in verdünnter Schwefelsäure gewonnen werden.<ref name="Levi" /> |
||
:<math>\mathrm{2\ BeCO_3 + H_2SO_4 \longrightarrow BeSO_4 + H_2O + CO_2 \uparrow}</math> |
:<math>\mathrm{2\ BeCO_3 + H_2SO_4 \longrightarrow BeSO_4 + H_2O + CO_2 \uparrow}</math> |
||
| Zeile 33: | Zeile 46: | ||
== Eigenschaften == |
== Eigenschaften == |
||
=== Physikalische Eigenschaften === |
=== Physikalische Eigenschaften === |
||
Vom Berylliumsulfat existieren mehrere Hydrate: Im Handel erhält man die Verbindung als Tetrahydrat mit der Summenformel BeSO<sub>4</sub> · 4 H<sub>2</sub>O, welches bei 111,5 °C in das Dihydrat BeSO<sub>4</sub> · 2 H<sub>2</sub>O, und bei 158 |
Vom Berylliumsulfat existieren mehrere Hydrate: Im Handel erhält man die Verbindung als Tetrahydrat mit der Summenformel BeSO<sub>4</sub> · 4 H<sub>2</sub>O,<ref>{{Literatur |Autor=Paul Schonefeld |Titel=Die Struktur des Berylliumsulfat-Tetrahydrates BeSO4·4H2O |Sammelwerk=Zeitschrift für Kristallographie – Crystalline Materials |Band=78 |Nummer=1-6 |Datum=1931-10-01 |DOI=10.1524/zkri.1931.78.1.16 |Seiten=16–41 }}</ref> welches bei 111,5 °C in das Dihydrat BeSO<sub>4</sub> · 2 H<sub>2</sub>O, und bei 158 °C in das Monohydrat BeSO<sub>4</sub> · H<sub>2</sub>O übergeht.<ref name="Levi">M. Levi-Malvano: ''Die Hydrate des Berylliumsulfats.'' In: ''Zeitschr. f. anorg. Chem.'' 1906, 48, S. 446ff. [http://www.archive.org/stream/zeitschriftfura45unkngoog#page/n465/mode/1up (Volltext)]</ref> Dieses kann dann bei ca. 400 °C zu wasserfreiem Berylliumsulfat entwässert werden. Das wasserfreie Sulfat selbst ist bis ca. 580 °C stabil.<ref name="Gmelin, Beryllium">''Gmelins Handbuch der Anorganischen Chemie.'' BERYLLIUM, System Nummer 26, Achte Auflage. Verlag Chemie, Berlin 1930.</ref> |
||
Ferner existiert ein Hexahydrat BeSO<sub>4</sub> · 6 H<sub>2</sub>O, das bei ca. 76 °C in das Dihydrat übergeht.<ref name="Levi"/> |
Ferner existiert ein Hexahydrat BeSO<sub>4</sub> · 6 H<sub>2</sub>O, das bei ca. 76 °C in das Dihydrat übergeht.<ref name="Levi" /> |
||
Wasserfreies Berylliumsulfat ist nur langsam und schlecht wasserlöslich. Dagegen ist das Tetrahydrat gut wasserlöslich. |
Wasserfreies Berylliumsulfat ist nur langsam und schlecht wasserlöslich. Dagegen ist das Tetrahydrat gut wasserlöslich. |
||
=== Chemische Eigenschaften === |
=== Chemische Eigenschaften === |
||
Im Salz liegt das Berylliumion als [Be(H<sub>2</sub>O)<sub>4</sub>]<sup>2+</ |
Im Salz liegt das Berylliumion als [Be(H<sub>2</sub>O)<sub>4</sub>]<sup>2+</sup> vor, da die Koordinationszahl 4 für Berylliumionen typisch ist (Hauptgruppenelement).<ref name="M. Binnewies">M. Binnewies: ''Allgemeine und Anorganische Chemie.'' 1. Auflage. 2004, ISBN 3-8274-0208-5, S. 355 f.</ref> |
||
Es bildet mit Alkalimetallsulfaten schlecht kristallisierende blumenkohlartige Krusten die als [[Doppelsalze]] mit der Summenformel Me<sub>2</sub>Be(SO<sub>4</sub>)<sub>2</sub> · 2 H<sub>2</sub>O aufgefasst werden, z.B.: K<sub>2</sub>Be(SO<sub>4</sub>)<sub>2</sub> · 2 H<sub>2</sub>O.<ref name="Gmelin, Beryllium"/> |
Es bildet mit Alkalimetallsulfaten schlecht kristallisierende blumenkohlartige Krusten die als [[Doppelsalze]] mit der Summenformel Me<sub>2</sub>Be(SO<sub>4</sub>)<sub>2</sub> · 2 H<sub>2</sub>O aufgefasst werden, z. B.: K<sub>2</sub>Be(SO<sub>4</sub>)<sub>2</sub> · 2 H<sub>2</sub>O.<ref name="Gmelin, Beryllium" /> |
||
== Biologische Bedeutung == |
== Biologische Bedeutung == |
||
| ⚫ | Berylliumsulfat ist äußerst giftig. Bei Ratten konnte auch eine stark [[karzinogen]]e Wirkung beobachtet werden.<ref name="Umwelt online">umwelt-online.de: {{Webarchiv|url=https://www.umwelt-online.de/regelwerk/t_regeln/trgs/trgs900/910/an14.htm |wayback=20180404073124 |text=''TRGS 910-14: Beryillium und seine Verbindungen''}}</ref> |
||
[[Datei:Beryllium sulfate.jpg|thumb|left|Handelsüblich verpacktes Berylliumsulfat-Tetrahydrat]] |
|||
| ⚫ | |||
Beim Menschen hingegen sind nur wenige Fälle bekannt. |
Beim Menschen hingegen sind nur wenige Fälle bekannt. |
||
== Vergiftung == |
== Vergiftung == |
||
Es sind verschiedene Formen von Berylliumvergiftungen bekannt, die zumeist von den Stäuben der Substanzen ausgehen: |
Es sind verschiedene Formen von Berylliumvergiftungen bekannt, die zumeist von den Stäuben der Substanzen ausgehen:<ref name="W. Forth">W. Forth: ''Allgemeine und spezielle Toxikologie und Pharmakologie.'' 6. Auflage. 1992, ISBN 3-411-15026-2, S. 781.</ref> |
||
'''Toxische [[Lungenentzündung|Pneumonie]]:''' |
'''Toxische [[Lungenentzündung|Pneumonie]]:''' |
||
| Zeile 61: | Zeile 73: | ||
Äußerst selten wird Berylliumsulfat auch in der [[Homöopathie]] eingesetzt. |
Äußerst selten wird Berylliumsulfat auch in der [[Homöopathie]] eingesetzt. |
||
== |
== Einzelnachweise == |
||
<references /> |
<references /> |
||
{{NaviBlock |
|||
|Navigationsleiste Erdalkalimetallsulfate |
|||
}} |
|||
{{Normdaten|TYP=s|GND=4144844-3}} |
|||
[[Kategorie:Sulfat]] |
[[Kategorie:Sulfat]] |
||
[[Kategorie:Berylliumverbindung]] |
[[Kategorie:Berylliumverbindung]] |
||
[[en:Beryllium sulfate]] |
|||
[[ja:硫酸ベリリウム]] |
|||
[[ru:Сульфат бериллия]] |
|||
Aktuelle Version vom 15. Oktober 2024, 01:04 Uhr
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
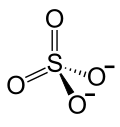
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Berylliumsulfat | ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 105,08 g·mol−1 (wasserfrei) 177,14 g·mol−1 (Tetrahydrat) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1205,2 kJ/mol[7] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Berylliumsulfat ist ein weißes Beryllium-Salz der Schwefelsäure mit der Summenformel BeSO4. Es wurde erstmals 1815 von Berzelius isoliert.[8]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Berylliumsulfat kann durch Auflösung von Berylliumcarbonat oder Berylliumhydroxid in verdünnter Schwefelsäure gewonnen werden.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Vom Berylliumsulfat existieren mehrere Hydrate: Im Handel erhält man die Verbindung als Tetrahydrat mit der Summenformel BeSO4 · 4 H2O,[10] welches bei 111,5 °C in das Dihydrat BeSO4 · 2 H2O, und bei 158 °C in das Monohydrat BeSO4 · H2O übergeht.[9] Dieses kann dann bei ca. 400 °C zu wasserfreiem Berylliumsulfat entwässert werden. Das wasserfreie Sulfat selbst ist bis ca. 580 °C stabil.[11] Ferner existiert ein Hexahydrat BeSO4 · 6 H2O, das bei ca. 76 °C in das Dihydrat übergeht.[9] Wasserfreies Berylliumsulfat ist nur langsam und schlecht wasserlöslich. Dagegen ist das Tetrahydrat gut wasserlöslich.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Im Salz liegt das Berylliumion als [Be(H2O)4]2+ vor, da die Koordinationszahl 4 für Berylliumionen typisch ist (Hauptgruppenelement).[12] Es bildet mit Alkalimetallsulfaten schlecht kristallisierende blumenkohlartige Krusten die als Doppelsalze mit der Summenformel Me2Be(SO4)2 · 2 H2O aufgefasst werden, z. B.: K2Be(SO4)2 · 2 H2O.[11]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Berylliumsulfat ist äußerst giftig. Bei Ratten konnte auch eine stark karzinogene Wirkung beobachtet werden.[13] Beim Menschen hingegen sind nur wenige Fälle bekannt.
Vergiftung
[Bearbeiten | Quelltext bearbeiten]Es sind verschiedene Formen von Berylliumvergiftungen bekannt, die zumeist von den Stäuben der Substanzen ausgehen:[14]
Toxische Pneumonie:
- nach wiederholter oder seltener einmaliger Inhalation mit wechselnder Latenzzeit von wenigen Tagen bis mehreren Jahren ohne erkennbaren Anlass
- Symptome sind Atemnot, Husten und Fieber
- Die Krankheit verläuft schleppend und Tod kann nach Monaten des Siechtums eintreten
Berylliose:
- eine sich langsam entwickelnde granulomatöse Reaktion des Lungengewebes ("Sandsturmlunge")
Verwendung
[Bearbeiten | Quelltext bearbeiten]Eine Mischung aus Berylliumsulfat und Radiumsulfat diente bei der Entdeckung der Kernspaltung als Neutronenquelle. Äußerst selten wird Berylliumsulfat auch in der Homöopathie eingesetzt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Datenblatt Berylliumsulfat bei Alfa Aesar, abgerufen am 11. März 2010 (Seite nicht mehr abrufbar).
- ↑ a b c d Eintrag zu Berylliumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Beryllium sulfate tetrahydrate bei Sigma-Aldrich, abgerufen am 7. Juli 2019 (PDF).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 903.
- ↑ Susan Budavari (Hrsg.): The Merck Index. 12. Auflage. Merck & Co., Whitehouse Station, New Jersey, USA 1996, ISBN 0-911910-12-3.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag beryllium compounds with the exception of aluminium beryllium silicates, and with those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- ↑ Ch. L. Parsons: The Chemistry and Literature of Beryllium. London 1909, S. 33 ff.
- ↑ a b c M. Levi-Malvano: Die Hydrate des Berylliumsulfats. In: Zeitschr. f. anorg. Chem. 1906, 48, S. 446ff. (Volltext)
- ↑ Paul Schonefeld: Die Struktur des Berylliumsulfat-Tetrahydrates BeSO4·4H2O. In: Zeitschrift für Kristallographie – Crystalline Materials. Band 78, Nr. 1-6, 1. Oktober 1931, S. 16–41, doi:10.1524/zkri.1931.78.1.16.
- ↑ a b Gmelins Handbuch der Anorganischen Chemie. BERYLLIUM, System Nummer 26, Achte Auflage. Verlag Chemie, Berlin 1930.
- ↑ M. Binnewies: Allgemeine und Anorganische Chemie. 1. Auflage. 2004, ISBN 3-8274-0208-5, S. 355 f.
- ↑ umwelt-online.de: TRGS 910-14: Beryillium und seine Verbindungen ( vom 4. April 2018 im Internet Archive)
- ↑ W. Forth: Allgemeine und spezielle Toxikologie und Pharmakologie. 6. Auflage. 1992, ISBN 3-411-15026-2, S. 781.


