Antistof (biologi)
For alternative betydninger, se Antistof. (Se også artikler, som begynder med Antistof)
Antistoffer eller immunglobuliner er en vigtig del af kroppens immunforsvar mod fremmede organismer, primært bakterier, svampe, virus og parasitter.





Antistoffer er effektive, fordi de er specialiserede til at kunne "genkende" bestemte immunogener eller antigener, derfor reagerer de hurtigt og præcist når for eksempel en mikroorganisme genkendes. Første gang kroppen udsættes for et antigen dannes et antistof mod dette. Bliver kroppen angrebet igen, er antistofferne klar. Plasmacellerne producerer størsteparten af antistofferne.
Immunglobulinernes fem klasser
redigérAntistofferne kaldes også immunglobuliner, heraf kommer forkortelsen Ig. Antistofferne udgør cirka 20% af plasmaets proteiner. Antistofferne kan inddeles i fem forskellige klasser:
- Immunoglobulin G (IgG) (75%), det almindelige antistof i blodplasmaet.
- Immunoglobulin A (IgA) (15%), sekretorisk antistof.
- Immunoglobulin M (IgM) (10%), første-respons-antistof.
- Immunoglobulin D (IgD) (0,2%), findes primært på overfladen af B-lymfocyter og en lille del i blodplasmaet.
- Immunoglobulin E (IgE) (0,004%), antistof mod parasitter og allergener.
Immunglobulinernes struktur
redigérIgG
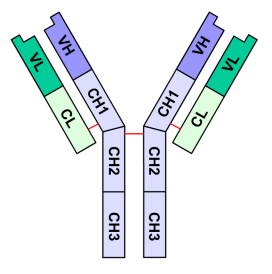
redigérImmunoglobulin G, IgG, ofte benævnt “monomer” selvom molekylet har to identiske halvdele med tilsammen to identiske bindingssæder for antigen. Et molekyle IgG består af to lette kæder (L, korte kæder) hver med et variabelt domæne, V, og et konstant domæne, C, og to tunge kæder (H, lange kæder) hver med et variabelt domæne, V, og tre konstante domæner, C. De lette og tunge kæder er bundet sammen af S-S-broer.
IgA
redigérImmunoglobulin A, IgA, “dimer” med fire bindingssæder for antigen. Et molekyle IgA er opbygget som to IgG-lignende molekyler forbundet med en J-kæde (J for joining) og en sc-kæde (sc for secretory component).
IgM
redigérImmunoglobulin M, IgM, “pentamer” med ti bindingssæder for antigen. Et molekyle IgM er opbygget som fem molekyler, hvoraf de to er forbundet med en J-kæde (J for joining). Til forskel fra IgG har de tunge kæder har et ekstra domæne og består af et variabelt domæne og fire konstante domæner. Monomererne er bundet sammen af S-S-broer.
IgD
redigérImmunoglobulin D, IgD, “monomer” med to bindingssæder for antigen. IgD ligner i opbygning IgG.
IgE
redigérImmunoglobulin E, IgE, “monomer” med to bindingssæder for antigen. IgE ligner i opbygning IgG med den undtagelse at de tunge kæder har et ekstra domæne og består af et variabelt domæne og fire konstante domæner.
IgY
redigérFugle, krybdyr, padder og lungefisk har immunglobuliner bl.a. i æggehviden, immunglobulin Y, IgY (Y for yolk). IgY er en “monomer” med to bindingssæder for antigen. IgY ligner i opbygning IgE med hensyn til de tunge kæder, der består af et variabelt domæne og fire konstante domæner.[1]
hcIgG
redigérCamelider, dvs kameler, dromedarer, lamaer og guanacoer, er enestående blandt pattedyrene ved at have immunglobuliner, hcIgG (hc for heavy chain), der kun består af to tunge kæder, hver med kun tre domæner, et variabelt domæne og to konstante domæner.[2]
IgNAR
redigérHajer har også immunglobuliner, IgNAR (NAR for new antigen receptor) der kun består af to tunge kæder, men med hver seks domæner, et variabelt domæne og fem konstante domæner.[3]
sdAbs, nanobodies
redigérEnkeltdomæne-antistoffer, sdAbs (single domain antibodies), populært kaldet nanobodies, består kun af det antigen-bindende domæne - det simpleste antistof, man kan tænke sig - og har potentiale som lægemiddel i en række sygdomme inkl. kræft.[4][5][6]
bsAbs
redigérBispecifikke antistoffer (bsAbs) er antistoffer med to bindings-domæner rettet mod to forskellige antigener eller to forskellige epitoper på det samme antigen. De kliniske terapeutiske virkninger af bsAbs er overlegne i forhold til monoklonale antistoffer med anvendelser til tumorimmunterapi såvel som til behandling af andre sygdomme.[7]
Immunoglobulin bioteknologi
redigérFremstilling, modificering og anvendelse af immunglobuliner udgør en stor del af den moderne bioteknologi, lige fra produktion af polyklonale og monoklonale antistoffer til deres anvendelse i monitering af sygdomsmarkører, forskning og sygdomsbekæmpelse.[8]
Immunglobulin-superfamilien
redigérImmunoglobulin-domænet er en type proteindomæne, der består af en sandwich på to β-ark bygget op af 7-9 antiparallelle β-tråde, der krydser mellem de to β-ark. Typisk består domænet af ca. 125 aminosyrer med en molekylvægt på 12-15 kDa.
Medlemmer af immunoglobulin-superfamilien udgør i hundredvis af proteiner med forskellige funktioner. Eksempler udover antistoffer, er celleadhæsionsmolekyler, kæmpe muskelproteinet titin og receptortyrosinkinaser. Immunglobulin-lignende domæner kan være involveret i bindinger imellem proteiner og imellem proteiner og ligander.
Der skelnes mellem fire underfamilier:
Se også
redigérKilder/henvisninger
redigér- ^ IgY-Antibodies from chicken eggs. Dianova 2014
- ^ Camelid Single-Domain Antibodies: Historical Perspective and Future Outlook. Frontiers in Immunology 2017
- ^ Structure of a shark IgNAR antibody variable domain and modeling of an early-developmental isotype. Protein Science 2005
- ^ Nanobodies and Nanobody-Based Human Heavy Chain Antibodies As Antitumor Therapeutics. Frontiers in Immunology 2017
- ^ Nanobodies – a smaller and better version of antibodies. Science Nordic 2020
- ^ Tiny llama nanobodies neutralize different noroviruses: Can they improve human anti-viral therapies? ScienceDaily 2023
- ^ Bispecific Antibodies: From Research to Clinical Application. Frontiers in Immunology 2021
- ^ Making antibodies work. Nature 2016
| Wikimedia Commons har medier relateret til: |