Svovel
| Svovel | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Svovel | ||
| Symbol | S | ||
| Atomnummer | 16 | ||
| Utseende | sitrongule krystaller | ||
| Plass i periodesystemet | |||
| Gruppe | 16 | ||
| Periode | 3 | ||
| Blokk | p | ||
| Kjemisk serie | ikke-metall | ||
| Atomegenskaper | |||
| Atomvekt | 32,065 u | ||
| Empirisk atomradius | 100 pm | ||
| Kalkulert atomradius | 88 pm | ||
| Kovalent atomradius | 102 pm | ||
| Elektronkonfigurasjon | [Ne] 3s2 3p4 | ||
| Elektroner per energinivå | 2, 8, 6 | ||
| Oksidasjonstilstander | ±2, 4, 6 | ||
| Krystallstruktur | ortorombisk | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 115,21 °C | ||
| Kokepunkt | 444,72 °C | ||
| Molart volum | 15,53 · 10-6 m³/mol | ||
| Tetthet | 1 960 kg/m³ | ||
| Hardhet | 2 (Mohs skala) | ||
| Kritisk temperatur | 1 314 K | ||
| Kritisk trykk | 20.7 MPa | ||
| Fordampningsvarme | 9,6 kJ/mol | ||
| Smeltevarme | 1,7175 kJ/mol | ||
| Damptrykk | 2,65 · 10-20 Pa ved 388 K | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 2,58 | ||
| Spesifikk varmekapasitet | 710 J/(kg · K) | ||
| Elektrisk ledningsevne | 5,0 · 10-22 S/m | ||
| Termisk konduktivitet | 0,269 W/(m · K) | ||
Svovel er et grunnstoff med kjemisk symbol S og atomnummer 16.
Historie
Eksistensen av svovel har vært kjent i Europa siden oldtiden. I bibelske skrifter ble lukten av svovel gitt som en beskrivelse av lukten i helvete. Forestillingen om at helvete var et sted med ild, lava og svovel har gitt opphav til begrepet svovelpredikant.
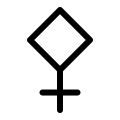
I Kina var stoffet kjent i det 6. århundre før kristi fødsel. Kineserne kalte svovels naturlige form shiliuhuang. I det 3. århundre oppdaget de at svovel kunne utvinnes fra svovelkis, og selv om interessen for brennbarheten var stor, var det til å begynne med anvendt til medisinske formål. I Song-dynastiet i 1044 ble forskjellige oppskrifter for svartkrutt beskrevet. Blandingen var av kaliumnitrat (KNO3), karbon og svovel. Tidlige alkymister ga svovel et eget symbol som var en triangel oppå et kors.
I 1777 overbeviste Antoine Lavoisier vitenskapsmiljøet at svovel var et grunnstoff og ikke en kjemisk forbindelse.
Det engelske navnet sulfur eller sulphur (gammel skrivemåte) er avledet av det latinske ordet sulpur, mens det norske ordet kommer fra tysk schwefel.

Egenskaper
Ved romtemperatur er svovel et sitrongult fast stoff. Rent svovel har bare en svak duft, ikke ulikt lukten fra fyrstikker. Mange forbinder svovel med lukten av råtne egg, men denne lukten kommer av gassen hydrogensulfid (H2S) og andre organiske svovelforbindelser, og ikke fra rent svovel. Svovel brenner med en blå flamme og avgir svoveldioksid som et resultat av forbrenningen.
Svovel er ikke løselig i vann. Det former imidlertid lett forbindelser med alle andre grunnstoff unntatt edelgassene. En spesiell egenskap ved svovel er at i flytende form øker viskositeten ved temperaturer over 200 °C på grunn av dannelsen av polymerer.
Svovel er viktig for levende organismer og forekommer i blant annet aminosyrer og enzymer.
Isotoper
Naturlig forekommende svovel består av 4 stabile isotoper: 32S (94,93%), 33S (0,76%), 34S (4,29%) og 36S (0,02%). I tillegg er 20 kunstig fremstilte ustabile (og dermed radioaktive) isotoper kjent. De mest stabile av disse er 35S med halveringstid 87,32 døgn, 38S med halveringstid 170,3 minutter, og 37S med halveringstid 5,05 minutter. Alle de resterende isotopene har halveringstider kortere enn 15 sekunder, og de fleste kortere enn 1 sekund.[1]
CAS-nummer: 7704-34-9
Forekomst

Svovel i ren form kan finnes ved varme kilder og vulkanske regioner i mange deler av verden. Gruvedrift etter slike forekomster skjer i Indonesia, Chile, Japan og Sicilia i Italia.
Betydelige svovelforekomster finnes også i mineralsk form, og er antatt å være et resultat av anaerobe bakterier, spesielt i gips. Kommersiell utvinning fra slike forekomstene skjer i USA, Polen, Russland, Turkmenistan og Ukraina.
Andre mineraler som inneholder svovel er sinober (kvikksølvsulfid), svovelkis (jernsulfid), blyglans (blysulfid), sinkblende (sinksulfid) og stibnitt (antimonsulfid).
Anvendelse
Svovel er en bra bakteriedreper. Derfor fungerer det bra som infeksjonshindring i sår etc. Det brukes også i fremstilling av svartkrutt.
Når svovel binder seg til metaller oppstår Sulfidmineraler.
Referanser
- ^ Lawrence Berkeley National Laboratory – Isotoptabell for svovel Arkivert 31. juli 2007 hos Wayback Machine.