Mangaan(IV)oxide
Mangaan(IV)oxide of mangaandioxide (ook bekend onder de naam bruinsteen of het Attenburrow-oxide) is een oxide van mangaan, dat in de aardkorst veel voorkomt onder de vorm van het mineraal pyrolusiet. De brutoformule is MnO2. De stof komt voor als een zwart kristallijn poeder, dat onoplosbaar is in water.
| Mangaan(IV)oxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
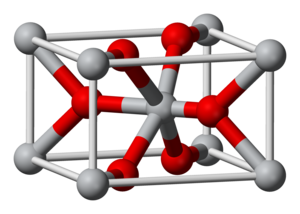
| ||||

| ||||
Mangaan(IV)oxide-poeder
| ||||
| Algemeen | ||||
| Molecuulformule | MnO2 | |||
| IUPAC-naam | mangaan(IV)oxide | |||
| Andere namen | mangaandioxide, bruinsteen, pyrolusiet, Attenburrow-oxide | |||
| Molmassa | 86,936849 g/mol | |||
| SMILES | O=[Mn]=O
| |||
| InChI | 1S/Mn.2O
| |||
| CAS-nummer | 1313-13-9 | |||
| EG-nummer | 215-202-6 | |||
| PubChem | 14801 | |||
| Wikidata | Q407674 | |||
| Beschrijving | Zwartbruin poeder met metaalglans | |||
| Vergelijkbaar met | mangaan(II)oxide | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H332 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P221 | |||
| MAC-waarde | 0,5 mg/m³ | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | zwartbruin | |||
| Dichtheid | 5,026 g/cm³ | |||
| Smeltpunt | (ontleedt) 535 °C | |||
| Onoplosbaar in | water | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−520,9 kJ/mol | |||
| S |
53,1 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
bewerkenMangaan(IV)oxide kan worden bereid door de thermolyse van mangaan(II)nitraat bij 500 °C:
De industriële synthese verloopt door de elektrolyse van een mangaan(II)sulfaat-oplossing. De Mn2+-ionen worden hierbij aan de anode geoxideerd tot Mn3+-ionen, die vervolgens disproportioneren tot Mn2+- en Mn4+-ionen.
Eigenschappen en reacties
bewerkenVan mangaan(IV)oxide bestaan verscheidene polymorfen, alsook een gehydrateerde vorm. Net zoals vele andere dioxiden kristalliseert mangaan(IV)oxide uit in de tetragonale rutielstructuur. Deze polymorf wordt aangeduid als β-MnO2; mangaan bezit hierbij een octaëdrische omringing.
Mangaan(IV)oxide kan worden gereduceerd tot metallisch mangaan door middel van een carbothermische reductie:
De kristallen lossen op in zwavelzuur, onder vorming van mangaan(II)sulfaat:
Vanwege de sterk oxiderende eigenschappen van mangaan(IV)oxide wordt het gebruikt om de waterstofhalogeniden te oxideren tot diatomaire halogenen (waarin X = fluor, chloor, broom of jood):
Boven 530 °C ontleedt mangaan(IV)oxide, waardoor mangaan(II,III)oxide en zuurstofgas worden gevormd:
Toepassingen
bewerkenbatterij
bewerkenMangaan(IV)oxide wordt onder andere gebruikt als kathodemateriaal in bepaalde type batterijen. In de zink-koolstofcel wordt mangaan gereduceerd:
In een alkalinebatterij wordt mangaanoxidehydroxide gevormd:
keramiek
bewerkenMangaan(IV)oxide wordt aangewend als toeslagmateriaal in klei om harde en niet-poreuze bakstenen te maken, die in de fundering worden gebruikt om als een vochtwerende laag te dienen. Gecoated op een titaniumanode kan het gebruikt worden als bescherming tegen oxidatie. Mangaan(IV)oxide katalyseert de disproportioneringsreactie van waterstofperoxide:
brandversneller
bewerkenIn de prehistorie werd mangaandioxide toegepast om vuur te maken. Mangaandioxidepoeder verlaagt de ontbrandingstemperatuur van hout van 350 naar 250 graden Celsius. Bruinsteenblokjes zijn door archeologen gevonden bij overblijfselen van Neanderthalers.[1][2]
Zie ook
bewerkenExterne links
bewerken- ↑ Maarten Keulemans, Rare afgeschraapte steentjes Neanderthalers blijken aanmaakblokjes. De Volkskrant (1 maart 2016). Gearchiveerd op 7 november 2017.
- ↑ Peter J. Heyes, Konstantinos Anastasakis, Wiebren de Jong, Annelies van Hoesel, Wil Roebroeks & Marie Soressi (2016). Selection and Use of Manganese Dioxide by Neanderthals. Scientific Reports 6 (22159). DOI: 10.1038/srep22159. Gearchiveerd van origineel op 9 februari 2022.
