Katekolamina
| Katekolamina |
|---|
 Epinefrina (Adrenalina) |
 Norepinefrina (Noradrenalina) |
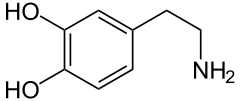 Dopamina |
Katekolamina ialah neurotransmiter monoamina, sebatian organik yang mempunyai katekol (benzena dengan dua kumpulan sampingan hidroksil bersebelahan antara satu sama lain) dan sisi rantai amina.[1]

Katekol boleh sama ada molekul bebas atau pengganti molekul yang lebih besar, di mana ia mewakili kumpulan 1,2-dihidroksibenzena.
Katekolamin ialah terbitan asid amino tirosina yang diperoleh daripada sumber pemakanan serta sintesis daripada fenilalanina.[2] Katekolamina adalah larut air dan 50% terikat kepada protein plasma dalam peredaran badan.
Termasuk di antara katekolamin ialah epinefrina (adrenalin), norepinefrina (noradrenalin) dan dopamina. Pembebasan hormon epinefrina dan norepinefrina daripada medula adrenal kelenjar adrenal adalah sebahagian daripada tindak balas lawan atau lari.[3]
Tirosina terhasil daripada fenilalanina melalui hidroksilasi enzim fenilalanina hidroksilase. Tirosina juga dimakan terus daripada protein pemakanan. Sel perembesan katekolamina menggunakan beberapa tindak balas untuk menukar tirosina secara bersiri kepada L-DOPA dan kemudian kepada dopamina. Bergantung pada jenis sel, dopamina boleh ditukar lagi kepada norepinefrina atau malah ditukar kepada epinefrina.[4]
Pelbagai ubat perangsang (seperti beberapa amfetamina bergantian) ialah analog katekolamina.
Struktur
suntingKatekolamin mempunyai struktur berbeza cincin benzena dengan dua kumpulan hidroksil, rantai etil perantaraan, dan kumpulan amina terminal. Phenylethanolamines seperti norepinephrine mempunyai kumpulan hidroksil pada rantai etil.[perlu rujukan]
Penghasilan dan penguraian
suntingL-Fenilalanina ditukar menjadi L-tirosina oleh enzim hidroksilase asid amino aromatik (AAAH) (fenilalanina 4-hidroksilase), dengan molekul oksigen (O2) dan tetrahidrobiopterin sebagai kofaktor. L-Tirosina kemudiannya ditukar menjadi L-DOPA oleh satu lagi AAAH (tirosina 3-hidroksilase) dengan tetrahidrobiopterin, O2 dan zat besi ferus (Fe2+) sebagai kofaktor. L-DOPA ditukar menjadi dopamina oleh enzim dekarboksilase asid L-amino aromatik (AADC), dengan piridoksal fosfat sebagai kofaktor. Dopamina juga merupakan bahan pendahulu bagi penghasilan norepinefrina dan epinefrina. Dopamina ditukar menjadi norepinefrina oleh dopamina β-hidroksilase (DBH) dengan O2 dan asid L-askorbik sebagai kofaktor. Norepinefrina ditukar enjadi epinefrina oleh feniletanolamina N-metiltransferase (PNMT) dengan S-adenosil-L-metionina sebagai kofaktor. |
Kedudukan
suntingKatekolamina dihasilkan terutamanya oleh sel kromafin medula adrenal dan gentian pascaganglion sistem saraf simpatetik. Dopamina yang bertindak sebagai neurotransmiter sistem saraf pusat, sebahagian besarnya dihasilkan dalam badan sel neuron di dua kawasan batang otak: kawasan tegmental ventral dan substantia nigra, yang terakhir mengandungi neuron berpigmen neuromelanin. Badan sel berpigmen neuromelanin yang serupa dari lokus koeruleus menghasilkan norepinefrina. Epinefrina dihasilkan dalam kumpulan kecil neuron dalam otak manusia yang mengekspresikan enzim sintesisnya, feniletanolamina N-metiltransferase;[8] neuron ini mengunjur dari nukleus bersebelahan (ventrolateral) ke kawasan postrema dan dari nukleus di kawasan dorsal saluran bersendirian.[8]
Biosintesis
suntingDopamine ialah katekolamin pertama yang disintesis daripada DOPA. Sebaliknya, norepinefrina dan epinefrina diperoleh daripada pengubahsuaian metabolik dopamina selanjutnya. Enzim dopamina hidroksilase memerlukan kuprum sebagai kofaktor (tidak ditunjukkan dalam rajah) dan DOPA dekarboksilase memerlukan PLP (tidak ditunjukkan dalam rajah). Langkah pengehad kadar biosintesis katekolamina melalui laluan metabolik utama ialah penghidroksilan L-tirosina kepada L -DOPA.[perlu rujukan]
Penguraian
suntingKatekolamin mempunyai separuh hayat beberapa minit apabila beredar dalam darah. Mereka boleh terurai sama ada melalui pemetilan oleh katekol-O-metiltransferase (COMT) atau dengan deaminasi oleh monoamina oksidase (MAO).
Perencat MAO mengikat MAO, dengan itu menghalangnya daripada memecahkan katekolamina dan monoamina lain.
Katabolisme katekolamin dimediasi oleh dua enzim utama: katekol-O-metiltransferase (COMT) yang terdapat dalam celah sinaps dan sitosol sel, dan monoamina oksidase (MAO) yang terletak dalam membran mitokondrion. Kedua-dua enzim memerlukan kofaktor: COMT menggunakan Mg2+ sebagai kofaktor manakala MAO menggunakan FAD. Langkah pertama proses katabolik dimediasi oleh sama ada MAO atau COMT yang bergantung kepada tisu dan lokasi katekolamina (contohnya degradasi katekolamina dalam celah sinaps dibantu oleh COMT kerana MAO ialah enzim mitokondrion). Langkah katabolik seterusnya dalam laluan melibatkan alkohol dehidrogenase, aldehid dehidrogenase dan aldehid reduktase. Hasil akhir epinefrina dan norepinefrina ialah asid vanililmandelik (VMA) yang dikumuhkan dalam air kencing. Katabolisme dopamina pula membawa kepada penghasilan asid homovanillik (HVA).[9]
Fungsi
suntingModaliti
suntingDua katekolamina, norepinefrina dan dopamina bertindak sebagai neuromodulator dalam sistem saraf pusat dan sebagai hormon dalam peredaran darah. Norepinefrina ialah neuromodulator sistem saraf simpatetik tepian tetapi juga terdapat dalam darah (kebanyakannya melalui "tumpahan" dari sinaps sistem simpatetik).[perlu rujukan]
Tahap katekolamina yang tinggi dalam darah dikaitkan dengan stres yang boleh disebabkan oleh tindak balas psikologi atau tekanan persekitaran seperti paras bunyi yang tinggi, cahaya cerah atau paras gula darah yang rendah.
Tahap katekolamina yang sangat tinggi (juga dikenali sebagai keracunan katekolamin) boleh berlaku dalam trauma sistem saraf pusat akibat rangsangan atau kerosakan nukleus dalam batang otak, khususnya, nukleus yang menjejaskan sistem saraf simpatetik. Dalam perubatan kecemasan, kejadian ini dikenali secara meluas sebagai "buangan katekolamina".
Paras katekolamin yang sangat tinggi juga boleh disebabkan oleh tumor neuroendokrin dalam medula adrenal, keadaan boleh rawat dikenali sebagai feokromositoma.
Tahap katekolamina tinggi juga boleh disebabkan oleh kekurangan monoamina oksidase A (MAO-A) yang dikenali sebagai sindrom Brunner. Oleh kerana MAO-A adalah salah satu enzim-enzim yang bertanggungjawab dalam penguraian, kekurangannya meningkatkan keberadaan neurotransmiter ini dengan ketara. Ia berlaku tanpa feokormositoma, tumor neuroendokrin dan sindrom karsinoid, tetapi ia kelihatan serupa dengan sindrom karsinoid dengan gejala seperti muka kemerahan dan sifat agresif.[10][11]
Porfiria akut boleh menyebabkan katekolamin tinggi.[12]
Kesan
suntingKatekolamina menyebabkan perubahan fisiologi umum yang menyediakan badan bagi aktiviti fizikal (lawan atau lari). Beberapa kesan biasa ialah peningkatan kadar denyutan jantung, tekanan darah, paras glukosa darah dan tindak balas umum sistem saraf simpatetik. Sesetengah ubat, seperti tolkapon (perencat COMT pusat), meningkatkan tahap semua katekolamina. Peningkatan katekolamina juga boleh menyebabkan peningkatan kadar pernafasan (takipnoa) terhadap pesakit.[13]
Katekolamin dirembeskan ke dalam air kencing selepas dipecahkan, dan tahap rembesannya boleh diukur untuk diagnosis penyakit yang berkaitan dengan tahap katekolamin dalam badan. [14] Ujian air kencing katekolamina digunakan untuk mengesan feokromositoma.
Ujian katekolamina
suntingUjian katekolamina dilakukan untuk mengenal pasti tumor langka pada kelenjar adrenal atau dalam sistem saraf. Ujian katekolamina memberikan maklumat relatif kepada tumor seperti feokromositoma, paraganglioma dan neuroblastoma.[15][16]
Rujukan
sunting- ^ Fitzgerald, P. A. (2011). "Chapter 11. Adrenal Medulla and Paraganglia". Dalam Gardner, D. G.; Shoback, D. (penyunting). Greenspan's Basic & Clinical Endocrinology (ed. 9th). New York: McGraw-Hill. Dicapai pada October 26, 2011.
- ^ Purves, D.; Augustine, G. J.; Fitzpatrick, D.; Hall, W. C.; LaMantia, A. S.; McNamara, J. O.; White, L. E., penyunting (2008). Neuroscience (ed. 4th). Sinauer Associates. m/s. 137–138. ISBN 978-0-87893-697-7.
- ^ "Catecholamines". Health Library. San Diego, CA: University of California. Diarkibkan daripada yang asal pada July 16, 2011.
- ^ Joh, T. H.; Hwang, O. (1987). "Dopamine Beta-Hydroxylase: Biochemistry and Molecular Biology". Annals of the New York Academy of Sciences. 493: 342–350. doi:10.1111/j.1749-6632.1987.tb27217.x. PMID 3473965.
- ^ Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". European Journal of Pharmacology. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ a b Kitahama, K.; Pearson, J.; Denoroy, L.; Kopp, N.; Ulrich, J.; Maeda, T.; Jouvet, M. (1985). "Adrenergic neurons in human brain demonstrated by immunohistochemistry with antibodies to phenylethanolamine-N-methyltransferase (PNMT): discovery of a new group in the nucleus tractus solitarius". Neuroscience Letters. 53 (3): 303–308. doi:10.1016/0304-3940(85)90555-5. PMID 3885079.
- ^ Eisenhofer, G.; Kopin, I. J.; Goldstein, D. S. (2004). "Catecholamine metabolism: a contemporary view with implications for physiology and medicine". Pharmacological Reviews. 3 (56): 331–349. doi:10.1124/pr.56.3.1. PMID 15317907.
- ^ Manor, I.; Tyano, S.; Mel, E.; Eisenberg, J.; Bachner-Melman, R.; Kotler, M.; Ebstein, R. P. (2002). "Family-Based and Association Studies of Monoamine Oxidase A and Attention Deficit Hyperactivity Disorder (ADHD): Preferential Transmission of the Long Promoter-Region Repeat and its Association with Impaired Performance on a Continuous Performance Test (TOVA)". Molecular Psychiatry. 7 (6): 626–632. doi:10.1038/sj.mp.4001037. PMID 12140786.
- ^ Brunner, H. G. (1996). "MAOA Deficiency and Abnormal Behaviour: Perspectives on an Association". Ciba Foundation Symposium. Novartis Foundation Symposia. 194: 155–167. doi:10.1002/9780470514825.ch9. ISBN 9780470514825. PMID 8862875.
- ^ Stewart, M. F.; Croft, J.; Reed, P.; New, J. P. (2006). "Acute intermittent porphyria and phaeochromocytoma: shared features". Journal of Clinical Pathology. 60 (8): 935–936. doi:10.1136/jcp.2005.032722. PMC 1994495. PMID 17660335.
- ^ Estes, Mary (2016). Health assessment and physical examination (ed. 2nd). Melbourne: Cengage. m/s. 143. ISBN 9780170354844.
- ^ "Catecholamines in Urine". webmd.com. Dicapai pada 4 May 2017.
- ^ "Catecholamine Urine & Blood Tests". WebMD (dalam bahasa Inggeris). Dicapai pada 2019-10-09.
- ^ "Catecholamines". labtestsonline.org (dalam bahasa Inggeris). Dicapai pada 2019-10-09.
Pautan luar
sunting- Catecholamines dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS