Alkanas
Alkanas yra organinis junginys, sudarytas tik iš anglies ir vandenilio atomų. Visi anglies atomai susijungę į tiesią arba šakotą grandinę, viengubomis jungtimis, o į „neišnaudotas“ jungtis prisijungęs vandenilis. Dar galimas anglies atomų susijungimas viengubomis jungtimis į žiedą, tokie junginiai vadinami cikloalkanais. Alkanai yra alifatiniai junginiai.
Bendroji cheminė formulė alkanų be žiedų yra CnH2n+2, kuriame n = 1, 2, 3, .. ir t. t. Paprasčiausias alkano pavyzdys yra metanas, CH4. Sekantis homologinėje eilėje yra etanas, C2H6, ir taip toliau. Kiekvienas anglies atomas alkane turi sp³ hibridizaciją.
Visi alkanai yra netirpūs vandenyje, hidrofobiški, o skysti alkanai labai gerai tirpsta riebaluose, yra lipofiliniai.[1] Alkanai kartais senesnėje literatūroje vadinami parafinais.
Izomerija
Pirmieji trys homologinės eilės nariai – metanas, etanas bei propanas – izomerų neturi, jie egzistuoja tik viena forma. Jei alkaną sudaro daugiau nei trys anglies atomai, jie gali išsidėstyti skirtingais būdais – sudaryti izomerus. Izomerais vadinami junginiai, turintys tą pačią molekulinę formulę, tačiau skirtingą atomų išsidėstymą molekulėje. Alkanai gali būti linijinės struktūros, ciklinės arba šakotos grandinės. Didėjant anglies atomų skaičiui molekulėje, galimų izomerų skaičius taip pat didėja.
| CnH2n+2, čia n = | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 20 |
| Izomerų skaičius | 1 | 1 | 1 | 2 | 3 | 5 | 9 | 18 | 35 | 75 | 366319 |

Nomenklatūra
Pirmųjų keturių alkanų – metano, etano, propano, butano – pavadinimai yra trivialieji. Kitų homologinės eilės narių pavadinimai sudaromi iš skaitvardžių, atitinkančių anglies atomų skaičių junginyje, pavadinimų graikų arba lotynų kalba, pridedant priesagą -an- ir galūnę -as: pvz., pentanas, heksanas, … , dekanas ir t. t.
Šakotos struktūros alkanai
Paprastai pavadinant šakotos struktūros alkanus pridedamas priešdėlis izo-. Remiantis IUPAC nomenklatūra, sudarant šakotos struktūros alkano pavadinimą, vadovaujamasi tokiomis taisyklėmis:
- randama ilgiausia anglies atomų grandinė, kuri duoda alkanui pavadinimą;
- jos anglies atomai numeruojami taip, kad pakaitai (radikalai) būtų žymimi mažiausiais skaičiais;
- pakaitai išvardinami abėcėlės tvarka;
- keli vienodi pakaitai žymimi priešdėliais di-, tri-, tetra- ir t. t. Pakaitų pavadinimai sudaromi iš alkanų pavadinimų priesagą -an- pakeičiant priesaga -il-.
2 – metilbutanas
Cikloalkanai
Cikloalkanų pavadinimai sudaromi taip pat kaip ir nešakotos grandinės alkanų pridedant priešdėlį ciklo-, pvz., ciklopentaną sudaro penki anglies atomai išsidėstę uždaroje grandinėje.
Fizikinės savybės
Konformacijos
Struktūrinė formulė ir cheminio ryšio kampas ne visada visiškai apibūdina molekulės geometrinį išsidėstymą. Cheminis ryšys tarp atomo ir atomų grupių gali pasisukti įvairiu kampu vienas kito atžvilgiu. Nuo posūkio kampo didumo molekulė įgyja skirtingas geometrines formas, vadinamas konformacijomis.
Etanas yra paprasčiausias junginys, kuriam būdingos konformacijos.

Metilo grupės etano molekulėje apsisukdavomos visa ratą, t. y. 360°, tris kartus būna sustabdytoje ir tris kartus užstotoje konformacijoje. Užstotoje konformacijoje abiejų anglies atomų vandenilio jonai yra priešpriešais, todėl posūkio įtampa, o dėl jos ir molekulės potencinė energija yra didžiausia. Todėl ši konformacija nepatvariausia ir joje molekulė būna trumpiausiai. Sustabdytosios konformacijos energija yra minimali dėl maksimalaus nuotolio tarp vandenilio atomų, todėl daugiausia etano molekulių yra šioje konformacijoje. Normaliomis sąlygomis tik 1 molekulė iš 1 000 turi pakankamai energijos, kad galėtų laisvai suktis apie σ ryšį. Kitos molekulės yra sustabdytoje konformacijoje.
Molekulės geometrija
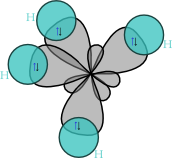
Molekulės geometrija labai lemia alkanų fizikines ir chemines savybes. Šios savybės priklauso nuo anglies elektronų konfigūracijos. Alkanų molekulėse elektronai yra sp³ hibridizacijos. Anglies atomas turi keturis velentinius elektronus, iš kurių vienas yra 2s orbitalėje, o kiti trys – 2p orbitalėje. Šios dvi orbitalės hibridizuojasi (vyksta orbitalių suvienodėjimas), jų energija suvienodėja, ir po hibridizacijos orbitalės išsidėsto erdvėje taip, kad jų ašys būna nukreiptos į teatraedro vršūnes. Kampas tarp ašių yra lygus 109,47°.
Cheminis ryšys
Alkanų molekulėse yra tik C – H ir C – C viengubi ryšiai. Ryšio tarp C – H (anglies ir vandenilio)atomų ilgis yra apytiksliai lygus 1,09×-1010 m, o tarp C – C atomų – 1,54×-1010 m.

Virimo temperatūra
| Pavadinimas | Molekulinė formulė | Virimo temperatūra/°C | Lydymosi temperatūra/°C | Tankis (būsena)/g cm -3(20°C) |
| Metanas | CH4 | -162 | -183 | dujos |
| Etanas | C2H6 | -89 | -172 | dujos |
| Propanas | C3H8 | -42 | -188 | dujos |
| Butanas | C4H10 | -0.5 | -135 | dujos |
| Pentanas | C5H12 | 36 | -130 | 0.626 |
| Heksanas | C6H14 | 69 | -95 | 0.659 |
| Heptanas | C7H16 | 98 | -91 | 0.684 |
| Oktanas | C8H18 | 126 | -57 | 0.703 |
| Nonanas | C9H20 | 151 | -54 | 0.718 |
| Dekanas | C10H22 | 174 | -30 | 0.730 |
| Undekanas | C11H24 | 196 | -26 | 0.740 |
| Dodekanas | C12H26 | 216 | -10 | 0.749 |
| Trikontanas | C30H62 | 343 | 37 | kietas |
Šaltiniai
- ↑ MEYER, Paul. Chemijos žinynas [iš vokiečių kalbos vertė Edita Paluckienė ir Egidijus Griškonis]. Kaunas: Šviesa, 2003, 91 p. ISBN 5-430-03542-4.
