Vaccino anti-poliomielite
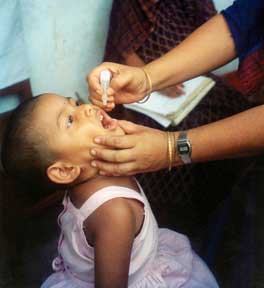
I due vaccini antipoliomielite oggi disponibili sono vaccini utilizzati in tutto il mondo per combattere la poliomielite. Il primo fu sviluppato da Jonas Salk e testato nel 1954. Annunciato al mondo da Salk il 12 aprile 1955, si compone di una dose di poliovirus inattivati (non-infettanti) da iniettare. Un vaccino orale fu sviluppato da Albert Sabin con poliovirus attenuati (alcuni anni prima, una sperimentazione analoga era stata tentata da Hilary Koprowski).
La sperimentazione umana del vaccino di Sabin è iniziata nel 1957, ed è stato approvato nel 1962.[1] Poiché non esiste uno stato a lunga permanenza di portatore per poliovirus in soggetti immunocompetenti, poiché il poliovirus non ha un serbatoio naturale che non sia l'uomo e poiché la sopravvivenza del virus nell'ambiente per un lungo periodo di tempo sembra essere remota, si ritiene che l'interruzione della trasmissione da persona a persona con la vaccinazione sia il passo fondamentale nell'eradicazione globale della malattia.[2]
I due vaccini hanno eliminato la poliomielite dalla maggior parte dei paesi del mondo[3][4] e hanno ridotto l'incidenza a livello mondiale da circa 350.000 casi registrati nel 1988 a 1.652 nel 2007,[5][6][7], sino al minimo storico di 223 casi nel 2012[8].
Storia
[modifica | modifica wikitesto]In senso generico, la vaccinazione funziona da innesco per il sistema immunitario. La stimolazione della risposta immunitaria mediante l'uso di un agente infettivo è nota come immunizzazione. L'immunità alla polio blocca efficacemente la trasmissione da persona a persona del poliovirus selvaggio, proteggendo in questo modo sia i soggetti vaccinati che la comunità (immunità di branco).[2]
Nel 1936, Maurice Brodie, un assistente ricercatore presso la New York University, tentò di produrre un vaccino antipolio utilizzando poliovirus uccisi con formaldeide e prelevati dal midollo spinale di una scimmia. Questi suoi tentativi sono stati però ostacolati dalla difficoltà di trovare un numero sufficiente di virus. Brodie testò il vaccino prima su sé stesso e poi su molti suoi assistenti. Lo inoculò poi a circa 3.000 bambini, molti dei quali ebbero reazioni allergiche, ma nessuno sviluppò l'immunità.[9] Il patologo di Philadelphia Giovanni Kolmer affermò di aver ottenuto un vaccino nello stesso anno, ma anch'esso non produsse immunità e fu accusato di aver provocato alcuni casi di poliomielite paralitica, nove dei quali mortali.[10]

Una svolta arrivò nel 1948, quando un gruppo di ricerca guidato da John Franklin Enders presso il Children's Hospital Boston coltivò con successo il poliovirus in tessuti umani in laboratorio.[11]
Questo e altri progressi nelle tecniche di laboratorio facilitarono notevolmente la ricerca sui vaccino e, infine, permisero di mettere a punto il vaccino antipoliomielite. Enders e i suoi colleghi, Thomas Huckle Weller e Frederick Chapman Robbins, furono premiati nel 1954 con un Premio Nobel per la medicina.[12] Altri importanti progressi che hanno portato allo sviluppo di vaccini antipolio sono stati: l'identificazione dei tre sierotipi di poliovirus (poliovirus tipo 1 — PV1, o Mahoney; PV2, Lansing; e PV3, Leon), la constatazione che prima della paralisi il virus deve essere presente nel sangue e la dimostrazione che la somministrazione di anticorpi sotto forma di gammaglobuline protegge dalla polio paralitica.[6][13]

Nel 1952 e nel 1953 negli Stati Uniti sorse un focolaio di poliomielite che fece contare rispettivamente 58.000 e 35.000 casi, fino ad arrivare ad un valore stabile di circa 20.000 casi l'anno. Durante queste epidemie, milioni di dollari furono investiti nella ricerca e commercializzazione di un vaccino antipolio. Tra i laboratori più impegnati in questa ricerca furono i laboratori Lederle a New York diretti da HR Cox. Vi lavorava il virologo e immunologo di origine polacca Hilary Koprowski, che sostenne di aver creato il primo vaccino antipolio funzionante nel 1950. Il suo vaccino, tuttavia, essendo un virus vivo attenuato e somministrato per via orale, era ancora in fase di ricerca e non sarebbe stato pronto per l'uso fino a cinque anni dopo che il vaccino antipolio di Jonas Salk (composto da virus morti e iniettabile) aveva raggiunto il mercato. il vaccino attenuato Koprowski veniva preparato mediante vari passaggi dei virus attraverso il cervello di topi albini svizzeri. Con il settimo passaggio, i ceppi del vaccino non potevano più infettare il tessuto nervoso o causare paralisi. Dopo 1-3 ulteriori passaggi sui ratti il vaccino veniva considerato sicuro per l'uso sull'uomo.[14][15] Il 27 febbraio 1950 il vaccino di Koprowski venne testato per la prima volta su un bambino di 8 anni che viveva a Letchworth Village, un istituto per disabili fisici e mentali con sede a New York. Non mostrando il bambino alcun effetto collaterale, Koprowski allargò l'esperimento ad altri 19 bambini.[14][16]
Lo sviluppo dei due vaccini antipolio ha portato alle prime vaccinazioni di massa moderne. Gli ultimi casi di poliomielite paralitica determinati dalla trasmissione endemica del virus selvaggio negli Stati Uniti si sono verificati nel 1979, con un'epidemia tra gli Amish in diversi stati del Midwest.[17] Uno sforzo globale per l'eradicazione della poliomielite, guidata dall'Organizzazione Mondiale della Sanità, dall'UNICEF e dal Rotary International, ha avuto inizio nel 1988 e si è affidata in gran parte al vaccino antipolio orale di Albert Sabin.[18] Nel 1994 la malattia è stata del tutto debellata nelle Americhe,[19] nel 2000 ufficialmente eradicata in 36 paesi del Pacifico occidentale, tra cui Cina e Australia.[20][21] L'Europa è stata dichiarata libera dalla poliomielite nel 2002.[22] A partire dal 2008, la poliomielite rimane endemica in soli quattro paesi: Nigeria, India, Pakistan e Afghanistan.[5] In India nuovi casi non sono più documentati dal 2011.[23] Anche se la trasmissione del poliovirus è stata interrotta in gran parte del mondo, quella del poliovirus selvaggio continua e crea un rischio permanente per l'importazione di esso nei paesi giudicati liberi. Se si dovessero verificare importazioni di poliovirus, si possono sviluppare focolai di malattia, soprattutto nelle zone con bassa copertura vaccinale e scarsa igiene. Perciò devono essere mantenuti elevati quantitivi di vaccino.[19]
Nel 2015 è stata finalmente annunciata l'eradicazione globale della poliomielite di tipo 2.[24]
Vaccino inattivo (di Salk)
[modifica | modifica wikitesto]
Il primo vaccino antipolio efficace fu sviluppato nel 1952 da Jonas Salk presso l'Università di Pittsburgh. Il 26 marzo 1953 Salk andò in onda sulla CBS segnalando gli ottimi risultati ottenuti dal suo team su un piccolo gruppo di adulti e bambini. Due giorni dopo tali risultati vennero pubblicati sul Journal of the American Medical Association.[25] Dato che la sperimentazione avrebbe richiesto diversi anni, per incoraggiarne la diffusione nel minor tempo possibile, Salk decise di non brevettare il vaccino. Celebre fu la sua risposta alla domanda del conduttore televisivo Edward R. Murrow "A chi appartiene il brevetto?" alla quale Salk rispose "Direi alla gente. Non esiste un brevetto. Si può forse brevettare il sole?"[26]
Il vaccino Salk, o polio inattivato (IPV), si basa su tre ceppi selvaggi, virulenti di riferimento: Mahoney (poliovirus di tipo 1), MEF-1 (poliovirus di tipo 2) e Saukett (poliovirus tipo 3), coltivati in un tipo di coltura tissutale ricavato dal rene di scimmia, che vengono poi inattivati con formalina.[6] Il vaccino iniettato Salk conferisce un'immunità IgG-mediata nel sangue, che impedisce la progressione dell'infezione da polio e protegge i motoneuroni, eliminando così il rischio di polio bulbare e la sindrome da post-poliomielite.
Il 23 febbraio 1954 il vaccino fu testato presso la scuola elementare e la Casa Watson per bambini di Pittsburgh, in Pennsylvania.[27] Il vaccino di Salk fu poi utilizzato in un test chiamato Field Trial Francis, guidato da Thomas Francis, il più grande esperimento medico della storia. Il test iniziò su circa 4000 bambini della scuola elementare Franklin Sherman a McLean, Virginia,[28] con l'intento di coinvolgere fino a 1,8 milioni di bambini in 44 stati dal Maine alla California.[29] Alla conclusione dello studio, circa 440.000 bambini ricevettero una o più iniezioni del vaccino e circa 210.000 bambini, invece, un placebo, costituito da terreni di coltura innocui. 1,2 milioni di bambini rimasero senza alcuna vaccinazione per fungere da gruppo di controllo, che sarebbe servito per vedere se la poliomielite veniva contratta.[14] I risultati della prova sul campo furono annunciati 12 aprile 1955 (il decimo anniversario della morte di Franklin Delano Roosevelt, anche lui vittima della malattia paralitica). Il vaccino Salk era stato per il 60-70% efficace contro il PV1 (poliovirus di tipo 1), oltre il 90% efficace contro il PV2 e il PV3 e il 94% efficace contro lo sviluppo della polio bulbare.[30] Poco dopo il vaccino di Salk fu autorizzato e nel 1955 partirono campagne di vaccinazione per i bambini. Negli Stati Uniti, a seguito di una campagna di vaccinazione di massa, il numero annuale di casi annuali di poliomielite scese da 35.000 nel 1953 a 5.600 nel 1957.[31] Nel 1961 negli Stati uniti furono registrati solo 161 casi.[32]

Un vaccino IPV più forte fu autorizzato negli Stati Uniti nel novembre 1987, ed è attualmente il vaccino di scelta in questo paese.[17]
La prima dose di vaccino contro la poliomielite viene somministrata poco dopo la nascita, di solito tra gli 1 e i 2 mesi di età, una seconda a 4 mesi di età.[17] I tempi della terza dose dipendono dalla formulazione del vaccino, ma deve essere somministrata tra i 6 e 18 mesi di età.[33] Una vaccinazione di richiamo viene fatta dai 4 ai 6 anni di età, per un totale di quattro dosi uguali da somministrarsi prima dell'inizio della scuola.[34] In alcuni paesi durante l'adolescenza viene fatta una quinta vaccinazione.[33] La vaccinazione di routine degli adulti (18 anni di età ed oltre) nei paesi sviluppati non è necessaria, né viene raccomandata poiché la maggior parte di essi è già immune e nei paesi d'origine ha un basso rischio di esposizione ai poliovirus selvaggi.[17]
Nel 2002 un vaccino pentavalente combinato (chiamato Pediarix) contenente IPV è stato approvato per uso negli Stati Uniti. Contiene anche combinati di difterite, tetano e pertosse acellulare (DTaP) e una dose pediatrica di vaccino contro l'epatite B.[17] Nel Regno Unito l'IPV è combinato con i vaccini contro tetano, difterite, pertosse e Haemophilus influenzae di tipo b.[33] Con la formulazione corrente dell'IPV, il 90% o più degli individui sviluppa anticorpi protettivi a tutti e tre i sierotipi di poliovirus dopo due dosi di vaccino e almeno il 99% risulta immune da poliovirus dopo tre dosi. La durata dell'immunità indotta da IPV non è certa, anche se una serie completa è ritenuta utile per fornire protezione per molti anni.[35]
Vaccino orale (di Sabin)
[modifica | modifica wikitesto]
Il vaccino orale (OPV) è un vaccino vivo attenuato, prodotto dal passaggio del virus attraverso cellule non umane con una temperatura sub-fisiologica, che produce mutazioni spontanee nel genoma virale.[36] I vaccini orali furono sviluppati da diversi gruppi di ricerca, uno dei quali fu condotto da Albert Sabin. Altri gruppi, guidati da Hilary Koprowski e HR Cox, svilupparono i loro propri ceppi vaccinali attenuati. Nel 1958 il National Institutes of Health creò un comitato speciale per i vaccini vivi antipolio. Fu attentamente valutata la capacità di diversi vaccini di indurre l'immunità al poliovirus pur mantenendo una bassa incidenza di neuropatogenicità nelle prove su scimmie. Studi clinici su larga scala effettuati in Unione Sovietica negli anni 1958 - 1959 da Mikhail Chumakov dimostrarono la sicurezza e l'efficacia del vaccino.[37][38] Sulla base di questi risultati, i ceppi di Sabin furono scelti per la distribuzione in tutto il mondo.[14]
Vi sono 57 sostituzioni nucleotidiche che caratterizzano il ceppo Sabin 1 attenuato dal suo genitore (il sierotipo Mahoney), due sostituzioni nucleotidiche per l'attenuazione del ceppo Sabin 2 e 10 sostituzioni sono coinvolte per attenuare il ceppo Sabin 3.[6] Il principale fattore attenuante comune a tutti e tre i vaccini Sabin è una mutazione che si trova nel sito di inserimento ribosomiale interno (IRES)[39] che altera da ansa a forcina le strutture e riduce la capacità del poliovirus di tradurre il suo stampo di RNA all'interno della cellula ospite.[40] Il poliovirus attenuato del vaccino Sabin si replica in modo molto efficiente nell'intestino, il sito primario di infezione e di replicazione, ma non riesce a replicarsi così bene nel tessuto del sistema nervoso. L'OPV ha anche dimostrato di essere più facile da somministrare, eliminando la necessità di siringhe sterili e rendendolo più adatto per le campagne di vaccinazione di massa. L'OPV fornisce anche l'immunità più duratura rispetto al vaccino Salk.
Nel 1961 il vaccino monovalente orale (MOPV) di tipo 1 e 2 fu autorizzato, mentre il tipo 3 ebbe la licenza l'anno successivo. Nel 1963 l'OPV trivalente (TOPV) fu messo in commercio e divenne il vaccino di scelta negli Stati Uniti e in molti altri paesi del mondo, in gran parte sostituendo il vaccino inattivato contro la polio.[9] Una seconda ondata di vaccinazioni di massa portò a un'ulteriore diminuzione del numero di casi di poliomielite. Tra il 1962 e il 1965 circa 100 milioni di americani (circa il 56% della popolazione in quel momento) ricevettero il vaccino Sabin, con una sostanziale riduzione del numero di casi, anche rispetto ai livelli già molto ridotti a seguito dell'introduzione del vaccino Salk.[41]
L'OPV è di solito fornito in flaconi da 10-20 dosi di vaccino. Una singola dose (di solito due gocce) contiene 1.000.000 unità infettive di Sabin 1 (efficace contro PV1), 100.000 unità infettive del ceppo 2 Sabin e 600.000 unità infettive di Sabin 3. Il vaccino è addizionato con tracce di antibiotici, la neomicina e la streptomicina, ma non ha conservanti.[42] Una dose di OPV produce immunità a tutti i tre sierotipi di poliovirus in circa il 50% dei destinatari.[17] Tre dosi di OPV producono anticorpi protettivi per tutti e tre i tipi di poliovirus in più del 95% dei riceventi. L'OPV dà un'eccellente immunità a livello intestinale, il sito primario di entrata dei poliovirus selvaggi, che aiuta a prevenire l'infezione in zone dove il virus è endemico.[34] I virus vivi utilizzati nel vaccino vengono espulsi con le feci e possono essere diffusi all'interno di una comunità, con conseguente protezione contro la poliomielite anche in individui che non sono stati vaccinati direttamente. L'IPV produce immunità gastrointestinale inferiore rispetto all'OPV e in primo luogo agisce impedendo al virus di entrare nel sistema nervoso. Nelle regioni prive di poliovirus selvaggio il vaccino antipolio inattivato è il vaccino di scelta.[34] In regioni con maggiore incidenza di polio, e quindi con un rischio diverso relativo tra efficacia e reversione del vaccino ad una forma virulenta, il vaccino vivo è ancora usato. Il vaccino con virus vivo ha lo svantaggio di dover rispettare requisiti rigorosi per il trasporto e stoccaggio, che rappresentano un problema in alcune zone calde o remote. Come con altri vaccini a virus vivo, l'immunità data dall'OPV probabilmente dura per tutta la vita.[35]
Poliomielite iatrogena
[modifica | modifica wikitesto]Una delle preoccupazioni principali riguardo al vaccino antipolio orale (OPV) è la sua nota capacità di tornare a una forma che può procurare l'infezione e causare la paralisi neurologica.[43] La malattia clinica, tra cui la paralisi, causata dal poliovirus derivato dal vaccino è indistinguibile da quella causata da poliovirus selvaggi.[44] Si ritiene, tuttavia, che ciò sia un evento raro, ma focolai di poliomielite paralitica associati al vaccino sono stati segnalati e tendono a verificarsi in aree a bassa copertura da OPV, presumibilmente perché l'OPV rappresenta la stessa protezione contro il ceppo epidemico correlato.[45][46]

Poiché l'incidenza della poliomielite selvaggia è diminuita, molte nazioni sono passate dall'uso del vaccino orale al vaccino iniettato poiché il rischio diretto di polio iatrogena (VAPP) causata dall'OPV supera il beneficio dell'immunizzazione. Quando viene utilizzato l'IPV, trattandosi di virus inattivati, non è possibile il ritorno a forme infettanti, tuttavia resta un piccolo rischio di infezione clinica in seguito all'esposizione da virus selvatici di polio o da virus OPV mutati nell'ambiente. Dopo l'ampio uso di vaccini antipolio a metà degli anni 1950, l'incidenza di poliomielite è diminuita rapidamente in molti paesi industrializzati. L'OPV non si usa più dal 2000 negli Stati Uniti, dal 2002 in Italia e dal 2004 nel Regno Unito, ma continua ad essere utilizzato prevalentemente per motivi economici nella maggior parte delle nazioni che presentano focolai.[17][33]
Il tasso di poliomielite paralitica associata al vaccino (VAPP) varia a seconda della regione, ma è generalmente di circa 1 caso ogni 750.000 soggetti vaccinati.[47] La VAPP è più probabile che si verifichi negli adulti che nei bambini. Nei bambini immunodeficienti il rischio di VAPP è quasi 7000 volte superiore, in particolare per le persone con patologie legate ai linfociti B (ad esempio, agammaglobulinemia e ipogammaglobulinemia), che riducono la sintesi degli anticorpi protettivi.[44] L'Organizzazione Mondiale della Sanità ritiene che i benefici della vaccinazione superino di gran lunga il rischio.[48]
Focolai di VAPP si sono verificati in modo indipendente in Bielorussia (1965-1966), in Canada (1966-68), in Egitto (1983-1993), nell'isola di Hispaniola (2000-2001), nelle Filippine (2001), nel Madagascar (2001-2002),[49] ed ancora ad Haiti (2002), dove la lotta politica e la povertà hanno interferito con le campagne di vaccinazione.[50] Nel 2006 un focolaio di poliovirus derivato dal vaccino si è verificato in Cina.[51] Sono stati, inoltre, riportati casi della Cambogia (2005-2006), Myanmar (2006-2007), Iran (1995, 2005-2007), Siria, Kuwait ed Egitto.[52] Dal 2005 l'Organizzazione Mondiale della Sanità monitora un focolaio di VAPP nel nord della Nigeria causato da una mutazione del vaccino in vivo antipolio per via orale.[53]
Controversie sul vaccino antipolio
[modifica | modifica wikitesto]Nel 1960 fu determinato che le cellule renali di Macaca mulatta utilizzate per la preparazione dei vaccini erano infettate dal virus SV-40, naturalmente presente nelle scimmie[54]. Nel 1961 fu dimostrato che tale virus può causare neoplasie nei roditori[55]. Più recentemente il virus è stato trovato in correlazione a certe forme di tumore negli esseri umani, più precisamente cervello, ossa, mesotelioma e certi tipi di linfoma non Hodgkin[56][57]. Tuttavia non è stato dimostrato che SV-40 possa causare neoplasie[58].
Il virus fu trovato nelle rimanenze dei vaccini iniettabili utilizzati tra il 1955 e il 1963[54], ma non in quelli a somministrazione orale[54]. Oltre 98 milioni di statunitensi hanno ricevuto una o più dosi di vaccino in tale periodo e si stima che, di questi, 10-30 milioni abbiano ricevuto quello contaminato con SV-40[54] Analisi successive fanno pensare che anche i vaccini prodotti dall'Unione Sovietica e utilizzati nel paese, in Cina, in Giappone e in diversi stati africani possano essere stati contaminati[59].
Nel 1998 uno studio promosso dal National Cancer Institute, basato sulle proprie banche dati relative ai casi di neoplasia, ha rivelato che non vi è stato un aumento dell'incidenza di tumori negli individui che hanno ricevuto il vaccino contaminato con il virus[60]. Un altro studio svedese ha esaminato i tassi relativi a 700.000 soggetti che hanno ricevuto vaccini potenzialmente contaminati fino al 1957, confermando che non vi era alcuna differenza relativa all'incidenza di neoplasie rispetto a chi non aveva ricevuto il vaccino[61]. La correlazione di causalità tra SV-40 e cancro rimane oggetto di dibattito e lo sviluppo di migliori esami diagnostici per la presenza del virus negli essere umani è ritenuto necessario per risolvere la controversia[58].
Durante il periodo di sviluppo di un vaccino da somministrare oralmente furono condotti numerosi studi di larga scala sugli esseri umani. Nel 1958 i National Institutes of Health determinarono che il vaccino orale ottenuto con i ceppi Sabin era il più sicuro[14]; tuttavia, tra il 1957 e il 1960, Koprowski continuò la somministrazione del proprio vaccino nel mondo. In Burundi, Ruanda e Congo furono vaccinate circa un milione di persone[62][63]. I risultati degli studi condotti sugli esseri umani sono oggetto di controversia[64] e, secondo una teoria ampiamente rifiutata e confutata[62], il vaccino avrebbe creato le condizioni necessarie per la trasmissione del virus SIV dagli scimpanzé all'uomo, originando il virus HIV responsabile dell'AIDS[62].
Dal 2004 i casi di poliomielite in Africa si sono ridotti a poche unità, soprattutto nella parte occidentale del continente; tuttavia, si sono sviluppate campagne di opposizione alla vaccinazione[65][66], spesso dovute ai timori che il vaccino possa portare a sterilità[67]. Come conseguenza si è assistito a un aumento dei casi in Nigeria e in diversi altri stati africani, dovuti, secondo gli epidemiologi, al rifiuto di alcune popolazioni locali di vaccinare i propri bambini[68].
Note
[modifica | modifica wikitesto]- ^ (EN) A Science Odyssey: People and Discoveries, su pbs.org, PBS, 1998. URL consultato il 29 novembre 2008.
- ^ a b Fine P, Carneiro I, Transmissibility and persistence of oral polio vaccine viruses: implications for the global poliomyelitis eradication initiative, in Am J Epidemiol, vol. 150, n. 10, 15 novembre 1999, pp. 1001–21, PMID 10568615.
- ^ Aylward RB, Eradicating polio: today's challenges and tomorrow's legacy, in Annals of Tropical Medicine and Parasitology, vol. 100, 5–6, 2006, pp. 401–13, DOI:10.1179/136485906X97354, PMID 16899145. URL consultato il 2 gennaio 2009.
- ^ Schonberger L, Kaplan J, Kim-Farley R, Moore M, Eddins D, Hatch M, Control of paralytic poliomyelitis in the United States, in Rev. Infect. Dis., 6 Suppl 2, 1984, pp. S424–6, PMID 6740085.
- ^ a b Centers for Disease Control and Prevention (CDC), Update on vaccine-derived polioviruses, in MMWR Morb. Mortal. Wkly. Rep., vol. 55, n. 40, ottobre 2006, pp. 1093–7, PMID 17035927.
- ^ a b c d Kew O, Sutter R, de Gourville E, Dowdle W, Pallansch M, Vaccine-derived polioviruses and the endgame strategy for global polio eradication [collegamento interrotto], in Annu Rev Microbiol, vol. 59, 2005, pp. 587–635, DOI:10.1146/annurev.micro.58.030603.123625, PMID 16153180.
- ^ Wild Poliovirus Weekly Update, su polioeradication.org, Global Polio Eradication Initiative, 25 novembre 2008. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 16 giugno 2008).
- ^ Global Polio Eradication Initiative > Data and monitoring > Polio this week
- ^ a b Pearce J, Salk and Sabin: poliomyelitis immunisation, in J Neurol Neurosurg Psychiatry, vol. 75, n. 11, 2004, p. 1552, DOI:10.1136/jnnp.2003.028530, PMC 1738787, PMID 15489385.
- ^ (EN) M. Rainsberger, More than a March of Dimes, su utexas.edu, The University of Texas at Austin, 27 giugno 2005. URL consultato il 19 maggio 2011 (archiviato dall'url originale il 1º giugno 2011).
- ^ Enders JF, Weller TH, Robbins FC, Cultivation of the Lansing Strain of Poliomyelitis Virus in Cultures of Various Human Embryonic Tissues, in Science, vol. 109, n. 2822, gennaio 1949, pp. 85–87, DOI:10.1126/science.109.2822.85, PMID 17794160.
- ^ The Nobel Prize in Physiology or Medicine 1954, su nobelprize.org, The Nobel Foundation. URL consultato il 29 novembre 2008.
- ^ Hammon W, Coriell L, Wehrle P, Stokes J, Evaluation of Red Cross gamma globulin as a prophylactic agent for poliomyelitis. IV. Final report of results based on clinical diagnoses, in J Am Med Assoc, vol. 151, n. 15, 1953, pp. 1272–85, PMID 13034471.
- ^ a b c d e Competition to develop an oral vaccine, su Conquering Polio, Sanofi Pasteur SA, 2 febbraio 2007 (archiviato dall'url originale il 7 ottobre 2007).
- ^ Weekly Reports for OCTOBER 10, 1947, in Public Health Rep, vol. 62, n. 41, ottobre 1947, pp. 1467–1498, PMC 1995293, PMID 19316151.
- ^ Hilary Koprowski, Interview with Hilary Koprowski, sourced at History of Vaccines website, su historyofvaccines.org, College of Physicians of Philadelphia, 15 ottobre 2010. URL consultato il 15 ottobre 2010.
- ^ a b c d e f g Atkinson W, Hamborsky J, McIntyre L, Wolfe S, eds., Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book) (PDF), 10th ed. (2nd printing), Washington, D.C., Public Health Foundation, 2008. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 24 settembre 2008).
- ^ Lisa Mastny, Eradicating Polio: A Model for International Cooperation, su worldwatch.org, Worldwatch Institute, 25 gennaio 1999. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 3 dicembre 2006).
- ^ a b Centers for Disease Control and Prevention (CDC), International Notes Certification of Poliomyelitis Eradication — the Americas, 1994, in Morbidity and Mortality Weekly Report, vol. 43, n. 39, Centers for Disease Control and Prevention, 1994, pp. 720–722, PMID 7522302.
- ^ ,, General News. Major Milestone reached in Global Polio Eradication: Western Pacific Region is certified Polio-Free (PDF), in Health Educ Res, vol. 16, n. 1, 2001, p. 109, DOI:10.1093/her/16.1.109.
- ^ D'Souza R, Kennett M, Watson C, Australia declared polio free, in Commun Dis Intell, vol. 26, n. 2, 2002, pp. 253–60, PMID 12206379.
- ^ Europe achieves historic milestone as Region is declared polio-free, su who.int, European Region of the World Health Organization, 21 giugno 2002. URL consultato il 23 agosto 2008.
- ^ Experts Report One of Two Remaining Types of Polio Virus May Be Eliminated in Pakistan, su sciencedaily.com, Science Daily, 13 novembre 2012.
- ^ Global eradication of wild poliovirus type 2 declared
- ^ Paul A. Offit, The Cutter Incident: How America's First Polio Vaccine Led to the Growing Vaccine Crisis, Yale University Press, 2007, p. 38, ISBN 0-300-12605-0.
- ^ Jane S. Smith, Patenting the Sun: Polio and The Salk Vaccine, New York, William Morrow, 1990, ISBN 0-688-09494-5.
- ^ Teri Shors, Understanding viruses, Jones & Bartlett Learning, 14 marzo 2008, pp. 294–, ISBN 978-0-7637-2932-5. URL consultato il 22 febbraio 2011.
- ^ David Oshinsky Archiviato il 10 marzo 2020 in Internet Archive. "Miracle Workers," American Heritage, Winter 2010.
- ^ Polio Victory Remembered as March of Dimes Marks 50th Anniversary of Salk Vaccine Field Trials, su News Desk, 26 aprile 2004. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 19 settembre 2008).
- ^ Jane S. Smith, Patenting the Sun: Polio and the Salk Vaccine, William Morrow & Co, 1990, ISBN 0-688-09494-5.
- ^ Sorem A, Sass EJ, Gottfried G, Polio's legacy: an oral history, Washington, D.C, University Press of America, 1996, ISBN 0-7618-0144-8.
- ^ Hinman A, Landmark perspective: Mass vaccination against polio, in JAMA, vol. 251, n. 22, 1984, pp. 2994–6, DOI:10.1001/jama.251.22.2994, PMID 6371280.
- ^ a b c d Joint Committee on Vaccination and Immunisation, David Salisbury (Editor), Mary Ramsay (Editor), Karen Noakes (Editor), 26: Poliomyelitis (PDF), in Immunisation Against Infectious Disease, Edinburgh, Stationery Office, 2006, pp. 313–29, ISBN 0-11-322528-8. URL consultato il 18 luglio 2012 (archiviato dall'url originale il 26 marzo 2009).
- ^ a b c Poliomyelitis prevention: recommendations for use of inactivated poliovirus vaccine and live oral poliovirus vaccine. American Academy of Pediatrics Committee on Infectious Diseases, in Pediatrics, vol. 99, n. 2, 1997, pp. 300–5, DOI:10.1542/peds.99.2.300, PMID 9024465. URL consultato il 18 luglio 2012 (archiviato dall'url originale il 30 settembre 2007).
- ^ a b Susan Robertson, Module 6: Poliomyelitis (PDF), su The Immunological Basis for Immunization Series, World Health Organization (Geneva, Switzerland). URL consultato il 29 novembre 2008 (archiviato dall'url originale il 24 marzo 2006).
- ^ Sabin A, Ramos-Alvarez M, Alvarez-Amezquita J, W Pelon, RH Michaels, I Spigland, MA Koch, JM Barnes e JS Rhim, Live, orally given poliovirus vaccine. Effects of rapid mass immunization on population under conditions of massive enteric infection with other viruses, in JAMA, vol. 173, 1960, pp. 1521–6, PMID 14440553.
- ^ Sabin AB, Role of my cooperation with Soviet scientists in the elimination of polio: possible lessons for relations between the U.S.A. and the USSR, in Perspect. Biol. Med., vol. 31, n. 1, 1987, pp. 57–64, PMID 3696960.
- ^ Benison S, International medical cooperation: Dr. Albert Sabin, live poliovirus vaccine and the Soviets, in Bull Hist Med, vol. 56, n. 4, 1982, pp. 460–83, PMID 6760938.
- ^ Ochs K, Zeller A, Saleh L, G. Bassili, Y. Song, A. Sonntag e M. Niepmann, Impaired Binding of Standard Initiation Factors Mediates Poliovirus Translation Attenuation, in J. Virol., vol. 77, n. 1, gennaio 2003, pp. 115–22, DOI:10.1128/JVI.77.1.115-122.2003, PMC 140626, PMID 12477816.
- ^ Gromeier M, Bossert B, Arita M, Nomoto A, Wimmer E, Dual Stem Loops within the Poliovirus Internal Ribosomal Entry Site Control Neurovirulence, in J. Virol., vol. 73, n. 2, febbraio 1999, pp. 958–64, PMC 103915, PMID 9882296.
- ^ Smallman-Raynor, Matthew, Poliomyelitis: A World Geography: Emergence to Eradication, Oxford University Press, USA, 2006, ISBN 0-19-924474-X.
- ^ Poliomyelitis Eradication: Field Guide, Washington, Pan American Health Organization, 2006, ISBN 92-75-11607-5.
- ^ Shimizu H, Thorley B, Paladin FJ, K. A. Brussen, V. Stambos, L. Yuen, A. Utama, Y. Tano e M. Arita, Circulation of Type 1 Vaccine-Derived Poliovirus in the Philippines in 2001, in J. Virol., vol. 78, n. 24, dicembre 2004, pp. 13512–21, DOI:10.1128/JVI.78.24.13512-13521.2004, PMC 533948, PMID 15564462.
- ^ a b Cono J, Alexander LN, Chapter 10: Poliomyelitis (PDF), su Vaccine-Preventable Disease Surveillance Manual, 3rd, 2002 (archiviato dall'url originale l'8 marzo 2010).
- ^ Kew O, V Morris-Glasgow, M Landaverde, C Burns, J Shaw, Z Garib, J André, E Blackman e CJ Freeman, Outbreak of poliomyelitis in Hispaniola associated with circulating type 1 vaccine-derived poliovirus, in Science, vol. 296, n. 5566, 2002, pp. 356–9, DOI:10.1126/science.1068284, PMID 11896235.
- ^ Yang CF, Naguib T, Yang SJ, E. Nasr, J. Jorba, N. Ahmed, R. Campagnoli, H. Van Der Avoort e H. Shimizu, Circulation of Endemic Type 2 Vaccine-Derived Poliovirus in Egypt from 1983 to 1993, in J. Virol., vol. 77, n. 15, agosto 2003, pp. 8366–77, DOI:10.1128/JVI.77.15.8366-8377.2003, PMC 165252, PMID 12857906.
- ^ Racaniello V, One hundred years of poliovirus pathogenesis, in Virology, vol. 344, n. 1, 2006, pp. 9–16, DOI:10.1016/j.virol.2005.09.015, PMID 16364730.
- ^ What is vaccine-derived polio?, su who.int, WHO, 8 ottobre 2007. URL consultato il 29 novembre 2008.
- ^ Kew O, Wright P, Agol V, F Delpeyroux, H Shimizu, N Nathanson e MA Pallansch, Circulating vaccine-derived polioviruses: current state of knowledge, in Bull World Health Organ, vol. 82, n. 1, 2004, pp. 16–23, DOI:10.1590/S0042-96862004000100006, PMC 2585883, PMID 15106296.
- ^ Maggie Fox, Polio in Haiti linked to incomplete vaccinations: Virus can mutate and kill, in National Post (Canada), 15 marzo 2002. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 3 giugno 2002).
- ^ Liang X, Zhang Y, Xu W, Ning Wen, Shuyan Zuo, Lisa A. Lee e Jingjin Yu, An outbreak of poliomyelitis caused by type 1 vaccine-derived poliovirus in China, in J Infect Dis, vol. 194, n. 5, 2006, pp. 545–51, DOI:10.1086/506359, PMID 16897650.
- ^ Centers for Disease Control and Prevention (CDC), Update on vaccine-derived polioviruses—worldwide, January 2006-August 2007, in MMWR Morb. Mortal. Wkly. Rep., vol. 56, n. 38, settembre 2007, pp. 996–1001, PMID 17898693.
- ^ Mutant polio virus spreads in Nigeria, in CBS News, 14 agosto 2009. URL consultato il 16 agosto 2009 (archiviato dall'url originale il 3 novembre 2013).
- ^ a b c d Simian Virus 40 (SV40), Polio Vaccine, and Cancer, su Vaccine Safety, Centers for Disease Control, 22 aprile 2004. URL consultato il 6 febbraio 2014 (archiviato dall'url originale il 22 maggio 2013).
- ^ BE. Eddy, GS. Borman; WH. Berkeley; RD. Young, Tumors induced in hamsters by injection of rhesus monkey kidney cell extracts., in Proc Soc Exp Biol Med, vol. 107, maggio 1961, pp. 191-7, PMID 13725644.
- ^ M. Carbone, Simian virus 40 and human tumors: It is time to study mechanisms., in J Cell Biochem, vol. 76, n. 2, dicembre 1999, pp. 189-93, PMID 10618636.
- ^ RA. Vilchez, CA. Kozinetz; AS. Arrington; CR. Madden; JS. Butel, Simian virus 40 in human cancers., in Am J Med, vol. 114, n. 8, giugno 2003, pp. 675-84, PMID 12798456.
- ^ a b EA. Engels, Cancer risk associated with receipt of vaccines contaminated with simian virus 40: epidemiologic research., in Expert Rev Vaccines, vol. 4, n. 2, aprile 2005, pp. 197-206, DOI:10.1586/14760584.4.2.197, PMID 15889993.
- ^ Bookchin D, Vaccine scandal revives cancer fear, su newscientist.com, New Scientist, 7 luglio 2004. URL consultato il 6 febbraio 2014 (archiviato dall'url originale il 20 luglio 2004).
- ^ HD. Strickler, PS. Rosenberg; SS. Devesa; J. Hertel; JF. Fraumeni; JJ. Goedert, Contamination of poliovirus vaccines with simian virus 40 (1955-1963) and subsequent cancer rates., in JAMA, vol. 279, n. 4, gennaio 1998, pp. 292-5, PMID 9450713.
- ^ P. Olin, J. Giesecke, Potential exposure to SV40 in polio vaccines used in Sweden during 1957: no impact on cancer incidence rates 1960 to 1993., in Dev Biol Stand, vol. 94, 1998, pp. 227-33, PMID 9776244.
- ^ a b c SA. Plotkin, CHAT oral polio vaccine was not the source of human immunodeficiency virus type 1 group M for humans., in Clin Infect Dis, vol. 32, n. 7, aprile 2001, pp. 1068-84, DOI:10.1086/319612, PMID 11264036.
- ^ K. Uno, [Studies on the pathogenic mechanism of beta-lactam hypersensitivity by the detection of leucocyte migration activating factor and leucocyte migration inhibitory factor]., in Arerugi, vol. 39, n. 12, dicembre 1990, pp. 1605-11, PMID 2096806.
- ^ Huntly Collins, The Gulp Heard Round the World, Philadelphia Inquirer, 6 novembre 2000, p. sezione D, pagina 1. URL consultato il 6 febbraio 2014 (archiviato dall'url originale il 5 aprile 2004).
- ^ (EN) Nigeria Muslims oppose polio vaccination, in Africa, BBC News, 27 giugno 2002. URL consultato il 6 febbraio 2014.
- ^ (EN) CW Dugger e DG McNeil, Rumor, Fear and Fatigue Hinder Final Push to End Polio, New York Times, 20 marzo 2006. URL consultato il 6 febbraio 2014.
- ^ Anti-polio vaccine Malians jailed, in Africa, BBC News, 12 maggio 2005. URL consultato il 6 febbraio 2014.
- ^ YY. Wen, [The depressor effect of antihypertensive factor from rat erythrocytes]., in Zhongguo Yi Xue Ke Xue Yuan Xue Bao, vol. 13, n. 3, giugno 1991, pp. 199-202, PMID 1831725.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto]Wikimedia Commons contiene immagini o altri file su Vaccino antipoliomielite
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) History of Vaccines Website, su historyofvaccines.org.
- (EN) Vaccines for Development, su blogs.cgdev.org, Center for Global Development. URL consultato il 18 luglio 2012 (archiviato dall'url originale il 4 aprile 2005).
- (EN) People and Discoveries: Salk Produces Polio Vaccine 1952, su pbs.org.
- (EN) Carlsen W, Rogue virus in the vaccine: Early polio vaccine harbored virus now feared to cause cancer in humans, San Francisco Chronicle, 15 luglio 2001. URL consultato il 29 novembre 2008 (archiviato dall'url originale il 19 ottobre 2011).
- (EN) Documents regarding Jonas Salk and the Salk Polio Vaccine, su eisenhower.archives.gov, Dwight D. Eisenhower Presidential Library.
- (EN) Smithsonian Magazine, Conquering Polio, su smithsonianmag.com, aprile 2005 (archiviato dall'url originale il 25 settembre 2009).
| Controllo di autorità | LCCN (EN) sh85104276 · J9U (EN, HE) 987007560732605171 |
|---|