Célula nai embrionaria
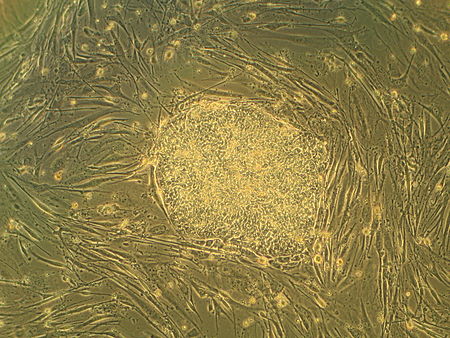

As células nai embrionarias (células ES ou ESC polas súas siglas en inglés de embryonic stem cells) son células nai pluripotentes derivadas da masa celular interna dun blastocisto, o cal é un dos estadios iniciais do embrión preimplantación.[1][2] Os embrións humanos chegan á etapa de blastocisto aos 4 ou 5 días despois da fecundación, momento en que constan de 50 a 150 células. Illar un embrioblasto ou masa celular interna ten como resultado a destrución do blastocisto, un proceso que presenta cuestións éticas, como se os embrións en fase de preimplantación deberían ter ou non a mesma consideración moral que os embrións na fase de postimplantación do desenvolvemento.[3][4]
As investigacións céntranse principalmente no potencial terapéutico das células embrionarias, e o uso clínico é o obxectivo de moitos laboratorios.[5] Os seus usos potenciais inclúen o tratamento da diabetes e as enfermidades cardíacas.[5] As células están sendo estudadas para o seu uso en terapias clínicas, modelos de tastornos xenéticos e reparación do ADN/celular. Porén, tamén se informaron dos efectos adversos desta investigación e en procesos clínicos como tumores e respostas inmunes non desexadas.[6]
Propiedades
[editar | editar a fonte]
As células nai embrionarias, derivadas do estadio de blastocisto de embrións de mamíferos temperáns, distínguense pola súa capacidade de diferenciarse en calquera tipo de célula embrionaria e pola súa capacidade de autorrenovarse. Estas características son as que as fan valiosas para a investigación científica e médica. As céllas nais embrionarias teñen un cariotipo normal, manteñen unha alta actividade de telomerase e mostran un salientable potencial proliferativo a longo prazo.[7]
Pluripotencia
[editar | editar a fonte]As células nai embrionarias da masa celular interna son a pluripotencia, o que significa que poden diferenciarse para xerar o ectoderma primitivo, que finalmente se diferencia durante a gastrulación en todos os derivados das tres capas xerminais primarias: ectoderma, endoderma e mesoderma. Estas capas xerminais xeran todos e cada un dos máis de 220 tipos celulares do corpo humano adulto. Cando se lles proporcionan os sinais axeitados, as células nai embrionarias forman inicialmente células precursoras que seguidamenre se diferencian nos tipos celulares desexados. A pluripotencia distingue as células nai embrionarias das células nai adultas, que son multipotentes e só poden producir un número limitado de tipos celulares.
Autorrenovación e reparación de estruturas
[editar | editar a fonte]En condicións definidas, as células nai embrionarias poden autorrenovarse indefinidamente permanecendo nun estado indiferenciado. As condicións de autorrenovación deben evitar que as células se agrupen e manteñan un ambiente que soporte un estado non especializado.[8] Tipicamente isto faise no laboratorio utilizando medios que conteñen soro e o factor inhibidor da leucemia ou suplementos de medios sen soro con dous fármacos inhibidores ("2i"), o inhibidor de MEK PD03259010 e o inhibidor de GSK-3 CHIR99021.[9]
Crecemento
[editar | editar a fonte]As células nai embrionarias divídense moi frecuentemente debido a que teñen unha fase G1 acurtada no seu ciclo celular. Unha división celular rápida permite a estas células crecer en número rapidamente, pero non en tamaño, o cal é importante para o desenvolvemento temperán do embrión. Nas células nai embrionarias as proteínas ciclina A e ciclina E implicadas na transición G1/S exprésanse sempre e a alto nivel.[10] As quinases dependentes de ciclina como CDK2, que promove a progresión do ciclo celular, están sobreactivadas, en parte debido á regulación á baixa dos seus inhibidores.[11] As proteínas do retinoblastoma que inhiben o factor de transcrición E2F ata que a célula está lista para entrar na fase S están hiperfosforiladas e inactivadas nas células nai embrionarias, o cal conduce á expresión continua de xenes de proliferación.[10] Estes cambios orixinan ciclos acelerados de división celular. Aínda que unha fase G1 acurtada foi ligada ao mantemento da pluripotencia,[12] as células nai embrionarias que crecen en condición 2i libres de soro expresan proteínas do retinoblastoma hipofosforiladas activas e teñen unha fase G1 alongada.[13] Malia esta diferenza no ciclo celular, cando as comparamos con células nai embrionarias que crecen en medios que conteñen soro, estas células teñen características pluripotentes similares.[14] Os factores de pluripotencia Oct4 e Nanog xogan un papel na reglación transcricional do ciclo celular das células nai embrionarias.[15][16]
Usos
[editar | editar a fonte]Debido á súa plasticidade e capacidade potencialmente ilimitada de autorrenovación, propuxéronse terapias con células nai para medicina rexenerativa e substitución de tecidos despois dunha lesión ou doenza. As células nai pluripotentes son prometedoras para tratar diversas condicións, como por exemplo as seguintes: lesións de medula espiñal, dexeneración macular relacionada coa idade, diabetes, trantornos neurodexenerativos (como a enfermidade de Parkinson), SIDA etc.[17] Ademais do seu potencial en medicina rexenerativa, as células nai embrionarias proporcionan unha fonte alternativa de tecidos ou órganos que sevirían como solución á escaseza de doantes para transplantes. Non obstante, isto presenta algunhas controversias éticas (ver a sección de máis abaixo "Debate ético"). Xunto con estes usos, as células nai embrionarias poden usarse para a investigación do desenvolvemento humano temperán, certas doenzas xenéticas e tests toxicolóxicos in vitro.[7]
Utilizacións
[editar | editar a fonte]Segundo un artigo de 2002 en PNAS, "as células nai embrionarias humanas teñen o potencial de diferenciarse en varios tipos de células e, así poden ser útiles como fonte de células para o transplante ou enxeñaría de tecidos."[18]

Porén, as células nai embrionarias non están limitadas á enxeñaría de células e tecidos.
Terapias de substitución de células
[editar | editar a fonte]A investigación actual está enfocada nas células nai embrionarias diferenciadas en diversos tipos celulares para un posible uso como células de terapia de substitución. Algúns dos tipos celulares que foron ou están a ser desenvolvidos son os cardiomiocitos, neuronas, hepatocitos, células da medula ósea, células dos illotes de Langerhans pancreáticos e células endoteliais.[19] Porén, a derivación de tales tipos celulares a partir de células nai embrionarias non carece de problemas, polo que as investigacións actuais están centradas en superar estas barreiras. Por exemplo, realízanse estudos para conseguir diferenciar células nai embrionarias en cardiomiocitos e para erradicar as súas propiedades inmaturas que as distinguen dos cardiomiocitos adultos.[20]
Potencial clínico
[editar | editar a fonte]- Obtivéronse células nai embrionarias diferencadas en células produtores de dopamina coa esperanza de que estas neuronas se poidan usar no tratamento da enfermidade de Parkinson.[21][22]
- As células nai embrionarias foron diferenciadas en células asasinas (NK) e do tecido óseo.[23]
- Estúdase o seu uso como tratamento alternativo para a diabetes. Por exemplo, D’Amour et al. conseguiron diferenciar células nai embrionarias en células que producen insulina[24] e investigadores da Universidade Harvard conseguiron poducir grandes cantidades de células beta pancreáticas a partir de células nai embrionarias.[25]
- Un artigo publicado no European Heart Journal describe un proceso traducional para xerar células proxenitoras cardíacas derivadas de células nai embrionarias para utilizalas en ensaios clínicos en pacientes con insuficiencia cardíaca grave.[26]
Descubrimento de fármacos
[editar | editar a fonte]Ademais de convertérense nunha alternativa importante para o transplante de órganos, as células nai embrionarias están utilizándose tamén no campo da toxicoloxía e como cribados celulares para descubrir novas entidades químicas que poidan desenvolverse como fármacos de baixo peso molecular. Os cardiomiocitos derivados de células nai embrionarias son validados en modelos in vitro para testar respostas a fármacos e predicir perfís de toxicidade.[19] Os cardiomiocitos derivados de células nai embrionarias responden a estímulos farmacolóxicos e, por tanto, poden utilizarse para estimar a cardiotoxicidade como nas torsades de pointes (puntas retortas nos picos do electrocardiograma).[27]
Os hepatocitos derivados de células nai embrionarias son tamén modelos útiles que poden utilizarse nos estadios preclínicos do descubrimento de fármacos. Porén, o desenvolvemento de hepatocitos a partir de células nai embrionarias ten moitas complicacións e isto dificulta a capacidade de testar o metabolismo dos fármacos. Por tanto, as investigacións actuais están dirixidas a establecer hepatocitos derivados de células nai embrionarias totalmente funcionais con actividade encimática estable en fase I e II.[28]
Modelos de trastornos xenéticos
[editar | editar a fonte]Varios estudos novos empezan a tratar a utilización como modelos de trastornos xenéticos das células nai embrionarias. A modelización de enfermidades xenéticas conseguiuse con células nai embrionarias manipulando xeneticamente as células ou, máis recentemente, derivando liñas celulares de enfermidades identificadas por diagnose xenética prenatal. Esta estratexia pode ser moi valiosa no estudo de trastornos como a síndrome do X fráxil, a fibrose quística e outras doenzas xenéticas que non teñen un sistema modelo fiable.
O investigador ruso-americano Yury Verlinsky, especializado en xenética embrionaria e celular (citoloxía xenética), desenvolveu métodos de tests de diagnose prenatal para determinar trastornos cromosómicos e xenéticos aplicables un mes e medio antes que a amniocentese estándar. As técnicas utilízanse agora por parellas que van ter fillos, especialmetne se teñen unha historia de anormalidades xenéticas ou en mulleres de máis de 35 anos (cando o risco de trastornos xenéticos é maior). Ademais, como permiten aos pais seleccionaren un embrión sen trastornos xenéticos, teñen o potencial de salvar as vidas de irmáns que xa tiveron trastornos e doenzas similares usando células procedentes dos fillos sen a doenza.[29]
Reparación de danos no ADN
[editar | editar a fonte]As células somáticas diferenciadas e as células nai embrionarias usan diferentes estratexias para tratar cos danos no ADN. Por exemplo, os fibroblastos humanos do prepucio do pene, un tipo de célula somática, usan a unión de extremos non homólogos (NHEJ), un proceso de reparación do ADN tendente ao erro, como vía principal para a reparación de roturas de dobre febra no ADN en todos os estadios do ciclo.[30] Debido á súa natureza tendente ao erro, o NHEJ adoita producir mutacións en descendentes clonais de células.
As células nai embrionarias usan unha estratexia diferente para tratar as roturas de dobre febra.[31] Como as células nai embrionarias dan lugar a todo tipo de células dun organismo incluíndo as células da liña xerminal, as mutacións que se orixinan nas células nai embrionarias debido a defectos na reparación do ADN son un problema máis grave que nas células que se diferenciaron a partir de células somáticas. En consecuencia, cómpre que existan mecanismos robustos nas células nai embrionarias para reparar os danos no ADN axeitadamente e, se falla a reparación, para eliminar aquelas células que teñan danos non reparados. Así, as células nai embrionarias de rato usan predominantemente o proceso de reparación recombinacional homóloga (HRR) de alta fidelidade para repararen as roturas de dobre febra.[31] Este tipo de reparación depende da interacción das dúas copias irmás do ADN formadas durante a fase S e que están presentes xuntas durante a fase G2 do ciclo celular. A HRR pode reparar con precisión as roturas de dobre febra nun comosoma ao usar información intacta da molécula irmá de ADN. As células na fase G1 do ciclo celular (é dicir, despois da metafase/división celular pero antes da seguinte rolda de replicación) teñen só unha copia de cada molécula de ADN (é dicir as moléculas irmás non están presentes). As células nai embrionarias de rato carecen do punto de comprobación de G1 e non sofren unha parada do ciclo celular ao sufriren danos no ADN.[32] En vez diso, sofren unha morte celular programada (apoptose) en resposta aos danos no ADN.[33] A apoptose pode utilizarse como unha estratexia de fallo de suguridade para eliminar células con danos no ADN non reparados para evitar as mutacións e a progresión ao cancro.[34] Consistente con esta estratexia, as células nai embrionarias de rato teñen unha frecuencia de mutación unhas 100 veces inferior que a das células somáticas de rato isoxénicas.[35]
Ensaio clínico en lesións medulares
[editar | editar a fonte]En xaneiro de 2009, un ensaio clínico en fase I para o transplante de oligodendrocitos (un tipo celular do cerebro e medula espiñal) derivados de céllas nai embrionarias a individuos con lesión de medula espiñal recibiu a aprobación da FDA dos Estados Unidos, no que foi o primeiro ensaio mundial con células nai embrionarias humanas.[36] O estudo que conduciu a este avance científico foi dirixido por Hans Keirstead e colegas na Universidade de California, Irvine e apoiado pola Geron Corporation de Menlo Park, CA, financiado por Michael D. West. Un experimento previo mostrara unha mellora na recuperación locomotora en ratas con lesión de medula espiñal despois de 7 días do transplante de células nai embrionarias que foron transformadas nunha liñaxe oligodendrocítica.[37] O estudo clínico en fase I foi deseñado para recrutar de 8 a 10 parapléxicos que tiveran a súa lesión non antes de dúas semanas de que empezase o ensaio, xa que as células deben ser inxectadas antes de que se forme tecido de cicatrización. Os investigadores enfatizaron que non se esperaba que as inxeccións curasen completamente os pacientes e restaurasen toda a súa mobilidade. Baseándose nos resultados de ensaios nos roedores, os investigadores especularon que se debería producir unha restauración das vaíñas de mielina e un incremento da mobilidade. O primeiro ensaio foi deseñado principalmente para comprobar a seguridade destes procedementos e se todo ía ben, esperábase que iso conduciría a furutos estudos en persoas con discapacidades máis graves.[38] O ensaio paralizouse provisoriamente en agosto de 2009 pola preocupación da FDA sobre a formación dun pequeno número de quistes microscópicos en varios modelos de ratas tratados, pero levantouse a paralización en xullo de 2010.[39]
En outubro de 2010 os investigadores recrutaron o primeiro paciente ao que administraron células nai embrionarias no Centro Shepherd de Atlanta.[40] Estimábase que habería que esperar varios meses para que as células nai se replicasen e a terapia GRNOPC1 puidese ser avaliada.
En novembro de 2011 Geron anunciou que ía parar o ensaio e abandonar a investigación en células nai por razóns financeiras, pero continuaría monitorizando os pacientes existentes, e que estaba intentando atopar un socio que continuase a investigación.[41] En 2013 BioTime, dirixido polo Dr. Michael D. West, adquiriu todos os valores relacionados coas células nai de Geron coa intención de recomezar o ensaio clínico sobre lesións de medula espiñal.[42]
A compañía de BioTime Asterias Biotherapeutics (NYSE MKT: AST) foi subvencionada con 14,3 millóns de dólares de diñeiro público da Strategic Partnership Award polo California Institute for Regenerative Medicine (CIRM) para reiniciar o primeiro ensaio clínico baseado en células nai embrionarias humanas en pacientes con lesión medular, na que foi a investigación sobre aplicación das células nai mellor financiada do mundo.[43] Con estes fondos Asterias reiniciou o ensaio con células AST-OPC1 en lesionados medulares e ampliou as probas clínicas escalando doses na poboación diana coa que se pretendían facer futuros ensaios.[43]
AST-OPC1 é unha poboación de células derivadas de células nai embrionarias humanas que contén células proxenitoras de oligodendrocitos (OPCs). Estas células proxenitoras e os seus derivados maduros, os oligodendrocitos (un tipo de célula glial), proporcionan un soporte esencial ás neuronas na medula espiñal e cerebro. Asterias presentou os resultados das probas en fase clínica I cunha dose baixa de AST-OPC1 en pacientes con lesión da medula espiñal torácica neuroloxicamente completa. Os resultados mostraron que as AST-OPC1 foron administradas con éxito no sitio da lesión. Os pacientes despois de 2 ou 3 anos da administración das AST-OPC1 non mostraron evidencias de episodios adversos graves asociados coas células nunha detallada avaliación de seguimento, que incluía frecuentes exames neurolóxicos e obtención de imaxes de resonancia magnética. A monitorización inmune dos suxeitos despois dun ano do transplante non mostrou evidencias de respostas baseadas en anticorpos ou de inmunidade celular ás AST-OPC1. En catro dos cinco suxeitos, realizáronse escáneres de resonancia magnética durante 2 ou 3 anos que mostraban unha redución da cavitación da medula espiñal e que as AST-OPC1 podían ter algúns efectos positivos na redución da deterioración do tecido medular espiñal. Non houbo dexeneración neurolóxica inesperada nin mellora nos cinco suxeitos estudados no ensaio avaliados polos estándares internacionais para a clasificación neurolóxica da lesión medular espiñal (ISNCSCI).[43]
A subvención da Strategic Partnership III do CIRM proporcionará fondos a Asterias para financiar o seu seguinte ensaio clínico con AST-OPC1 en lesionados medulares e para o desenvolvemento de produtos para refinar e escalar os seus métodos de fabricación para manter ensaios nas seguintes fases e finalmente para a súa comercialización. O acordo definitivo entre Asterias e o CIRM está condicionado a que a FDA aprobe os ensaios.[43]
Preocupacións e polémicas
[editar | editar a fonte]Efectos adversos
[editar | editar a fonte]A maior preocupación que suscita o transplante de células nai embrionarias en pacientes como terapia é a súa capacidade de formar tumores, incluíndo os teratomas.[44] As cuestións de seguridade foron as que motivaron que a FDA paralizase provisoriamenrte o primeiro ensaio clínico con estas células, pero nel non se observaron tumores.
A principal estratexia para potenciar a seguridade das células nai embrionarias para usos clínicos é diferencialas en tipos celulares específicos (por exemplo neuronas, células musculares, do fígado etc.) que reduciron ou eliminaron a súa capacidade de causar tumores. Despois da diferenciación, as células son escollidas por medio dunha citometría de fluxo para unha maior purificación. Predise que as células nai embrionarias son inherentemente máis seguras que as células iPS creadas con vectors virais integrados xeneticamente porque non están modificadas xeneticamente con xenes como c-Myc, que están ligados ao cancro. Non obstante, as células nai embrionarias expresan niveis moi altos de xenes indutores de iPS e estes xenes, incluíndo o Myc, son esenciais para a autorrenovación e pluripotencia das células nai embrionarias,[45] e as estratexias potenciais para mellorar a seguridade eliminando a expresión de c-Myc é improbable que conserven nelas o carácter de célula nai. Porén, N-myc e L-myc inducen células iPS en vez de c-myc con eficiencia similar.[46] Protocolos máis recentes para inducir a pluripotencia sortean este problema completamente ao usaren vecrores de ARN viral non integrados como os virus sendai ou transfección de ARNm.
Debate ético
[editar | editar a fonte]Debido á natureza embrionaria destas células nai, hai moitas opinións controvertidas sobre o asunto. Como para recoller as células nai embrionaria cómpre destruír un embrión humano, o status moral dese embrfión entra en cuestión. Algunhas persoas argumentan que unha masa de células que constitúe un embrión de 5 días é denmasiado xove como para darlle status de persoa ou que os embrións, cando son doados por clínicas de fecundación in vitro (que é onde se obteñen normalmente os embrións para estas investigacións), serían en calquera caso ao final eliminados como residuos médicos. Os opoñentes a estas investigacións consideran que ese embrión é unha vida humana, polo que destruílo é un asasinato e que o embrión debe ser proteexido co mesmo pnto de vista ético que un ser humano máis desenvolvido.[47]
Historia
[editar | editar a fonte]- 1964: Lewis Kleinsmith e G. Barry Pierce Jr. illaron un só tipo de célula dun teratocarcinoma, un tumor que agora se sabe procede dunha célula xerminal.[48] Estas células foron illadas do teratocarcinoma replicado e creceron nun cultivo celular como unha célula nai e coñécense agora como células de carcinoma embrional. Aínda que as semellanzas en morfoloxía e potencial diferenciador (pluripotencia) levaron ao uso de células nai embrionarias como modelo in vitro do desenvolvemento temperán dos ratos,[49] as células nai embrionarias teñen mutacións xenéticas e a miúdo cariotipos anormais que se acumularon durante o desenvolvemento do teratocarcinoma. Estas aberracións xenéticas salientan aínda máis a necesidade de poder cultivar células pluripotentes directamente a partir da masa celular interna do embrión.

- 1981: as células nai embrionarias foron derivadas independentemente por primeira vez de embrións de rato por dous grupos. Martin Evans e Matthew Kaufman do Departamento de Xenética da Universidade de Cambridge publicaron primeiro en xullo, describindo unha nova técnica para cultivar embrións de rato no útero para conseguir un incremento no número de células, permitindo a derivación de células nai embrionarias a partir deses embrións.[50] Gail R. Martin do Departamento de Anatomía da Universidade de California, San Francisco, publicou o seu artigo en decembro e acuñou o termo “célula nai embrionaria”.[51] Esta investigadora demostrou que os embrións podían ser cultivados in vitro e que as células nai embrionarias podían derivarse deses embrións.
- 1989: Mario R. Cappechi, Martin J. Evans e Oliver Smithies publicaron as súas investigacións que detallan o seu illamento e modificaciós xenéticas de células nai embrionarias, creando o primeiro "rato knockout".[52] Ao crearen ratos knockout, esta publicación creou un novo xeito de estudar as enfermidades.
- 1998: un equipo da Universidade de Wisconsin, Madison (James A. Thomson, Joseph Itskovitz-Eldor, Sander S. Shapiro, Michelle A. Waknitz, Jennifer J. Swiergiel, Vivienne S. Marshall e Jeffrey M. Jones) publicaron un artigo titulado "Liñas de células nai embrionarias derivadas de blastocistos humanos". Estes investigadores non só crearon as primeiras células nai embrionarias, senón que recoñeceron a súa pluripotencia e a súa capacidade de autorenovación. O resumo do artigo sinala a importancia do descubrimento nos campos da bioloxía do desenvolvemento e o descubrimento de fármacos.[53]
- 2001: o presidente dos Estados Unidos de América George W. Bush permite a financiamento federal de investigacións con 60 liñas de células nai embrionarias xa existentes daquela, pero non coas derivadas da creación de novas liñas.[54]
- 2006: os científicos xaponeses Shinya Yamanaka e Kazutoshi Takashi publicaron un artigo no que describían a indución de células nai pluripotentes a partir de cultivos de fibroblastos de rato. As células nai pluripotentes inducidas ou iPSCs foron un gran descubrimento, xa que son practicamednte idénticas ás células nai embrionarias e poderían usarse sen suscitar polémicas morais.[55]
- Xaneiro de 2009: a FDA norteamericana dá a súa aprobación apara realizar o ensaio en fase I de Geron Corporation do seu tratamento baseado en células nai embrionarias para as lesións de medula espiñal. As súas células nai derivaban das liñas permitidas pola administración de George W. Bush.[56]
- Marzo de 2009: unha orde executiva asinada polo presidente dos Estados Unidos Barack Obama, elimina as restricións sobre asignación de fondos federais á investigación sobre células nai embrionarias impostas pola anterior administración.[57]
Técnicas e condicións para a derivación e cultivo
[editar | editar a fonte]Derivación de embrións humanos
[editar | editar a fonte]Para realizar unha fecundación in vitro hai que xerar múltiples embrións. Os embrións en exceso non se usan clinicamente ou non son axeitados para a súa implantación no paciente, e, por tanto, poden ser doados co consentimento do doante. As células nai embrionarias poden derivarse destes embrións procedentes de doazóns ou adicionalmente poden tamén extraerse de embrións clonados usando unha célula do paciente e un óvulo dun doante.[58] As células da masa interna do embrión (que son as células de interese), presentes no estadio de blastocisto, sepáranse do trofoectoderma, estas últimas son as células que se diferenciarían en tecidos extraembrionarios. Para realizar a separación utilízanse a inmunocirurxía (o proceso polo cal os anticorpos se unen ao trofoectoderma e son despois retirados por outra solución) e a disección mecánica. As células resultantes da masa celular interna son cultivadas sobre capas de células que lles darán soporte. As células da masa interna únense e expándense máis para formar unha liña de células nai embrionarias humanas, que están indiferenciadas. Estas células son alimentadas diariamente e son separadas enzimatica ou mecanicamente cada catro a sete días. Para que teña lugar a diferenciación, a liña de células nai embrionarias humanas é retirada das células que lle serven de soporte para formar corpos embrioides, é cocultivada cun soro que contén os sinais necesarios ou é enxertada nun armazón tridimensional.[59]
Derivacion doutros animais
[editar | editar a fonte]As células nai embrionarias derivan das células da masa interna das fases temperán do embrión, que se recollen dun animal femia doante. Martin Evans e Matthew Kaufman informaron dunha técnica que atrasa a implantación do embrión, o que permite que a masa de células internas se incremente. Este proceso inclúe a extirpación dos ovarios da nai e darlle doses de proxesterona, cambiando o ambiente hormonal, que causa que os embrións permanezan libres no útero. Despois de 4 a 6 días deste cultivo intrauterino, os embrións son recollidos e póñense a crecer en cultivo in vitro ata que a masa celular interna forma “estruturas de tipo cilíndrico de ovos”, que son disociadas en células simples, e cultivadas sobre unha capa de fibroblastos tratados con mitomicina-c (para impedir a mitose dos fibroblastos). As liñas celulares clonais son creadas para que dean lugar a un só tipo de célula. Evans e Kaufman demostraron que as células que crecen a partir deses cultivos podían orixinar teratomas e corpos embrioides e diferéncianse in vitro, todo o cal indica que as células son pluripotentes.[50]
Gail Martin derivou e cultivou as súas células nai embrionarias de xeito diferente. Ela retirou os embrións da nai doante a aproximadamente 76 horas despois da copulación e cultivounas durante toda unha noite nun medio que contiña soro. Ao día seguinte, retirou a masa celular interna do blastocisto tardío usando microcirurxía. A masa celular interna extraída foi cultivada sobre fibroblastos tratados con mitomicina-c nun medio que contén soro e coas condicións necesarias. Pasada aproximadamente unha semana, crecen as colonias de células. Estas células crecen en cultivo e demostran ter características pluripotentes como se demostra pola súa capacidade de producir teratomas, diferenciarse in vitro, e formar corpos embrioides. Martin denominou estas células células nai embrionarias.[51]
Agora sábese que as células alimentadoras (fibroblastos) proporcionan o factor inhibidor da leucemia e o soro proporciona proteínas morfoxenéticas óseas (BMPs) que son necesarias para impedir que as células nai embrionarias se diferencien.[60][61] Estes factores son extremadamente importantes para a eficiencia das células nai embrionarias derivadas. Ademais, demostrouse que diferentes cepas de ratos teñen diferentes eficiencias para illar células nai embrionarias.[62] Os usos actuais das células nai embrionarias de rato inclúen a xeración de ratos transxénicos, incluíndo os ratos knockout. Para o tratamento humano, non hai necesidade de células pluripotentes específicas do paciente. A xeración de células nai embrionarias humanas é máis difícil e presenta cuestións éticas. Así, ademais da investigación en células nai embrionarias humanas, moitos grupos están centrándose na xeración de células nai pluripotentes inducidas (células iPS).[63]
Posible método para a derivación dunha nova liña celular
[editar | editar a fonte]O 23 de agosto de 2006 a edición en liña da revista Nature publicou unha carta do Dr. Robert Lanza (director médico de Advanced Cell Technology de Worcester, MA) na que se afirmaba que o seu equipo atopara un modo de extraer células nai embrionarias sen destruír o embrión.[64] Este logro técnico podería permitir aos científicos traballar con novas liñas de células nai embrionarias derivadas usando financiamento público nos Estados Unidos, onde o financiamento federal estaba ata ese momento limitado ás investigacións con liñas de células nai embrionarias que foran derivadas con anterioridade a agosto de 2001. En marzo de 2009 esta limitación foi levantada.[65]
Células nai pluripotentes inducidas (iPS)
[editar | editar a fonte]- Artigo principal: Célula nai pluripotente inducida.
A tecnoloxía das iPSC foi iniciada polo laboratorio de Shinya Yamanaka en Kyoto, Xapón, que mostrou en 2006 que a introdución de catro xenes específicos que codifican factores de transcrición poderían converter células adultas en células nai pluripotentes.[66] Foi galardoado en 2012 co Premio Nobel xunto con John Gurdon "polo descubrimento de que células maduras poden sedr reprogramadas para converterse en pluripotentes." [67]
En 2007 demostrouse que células nai pluripotentes moi similares a células nai embrionarias poden xerarse pola intodución de tres xenes (Oct4, Sox2 e Klf4) en células diferenciadas.[68] A introdución destes xenes "reprograma" células diferenciadas en células nai pluripotentes, o que permite a xeración de células nai pluripotentes sen o embrión. Debido ás preocupacións éticas sobre as células nai embrionarias pola súa derivación de embrións, crese que a reprogramación destas células nai pluripotentes inducidas pode ser menos controvertida. Tanto as células humanas coma as de ratos poden ser reprogramadas por esta metodoloxía, xerando células nai pluripotentes humanas e de rato sen utilizar embrións.[69]
Isto pode permitir a xeración de liñas de células nai embrionarias específicas de pacientes que poderían utilizarse para terapias de substitución de células. Ademais, isto permitirá a xeración de liñas celulares de células nai embrionarias a partir de pacientes con diversas doenzas xenéticas e proporcionará modelos ter moi valiosos para estudas esas doenzas.
Porén, como unha primeira indicación de que a tecnoloxía das células nai pluripotentes inducidas (iPS) pode conseguir rápidas curacións, foi utilizada por un equipo investigador encabezado por Rudolf Jaenisch do Instituto Whitehead para a investigación biomédica de Cambridge, Massachusetts, para curar ratos da anemia falciforme, como se informou na revista Science na súa edición on line do 6 de decembro de 2007.[70][71]
O 16 de xaneiro de 2008, unha compañía radicada en California, Stemagen, anunciou que creara os primeiros embrións humanos clonados maduros a partir dunha célula da pel tomada de adultos. Destes embrións poden obterse células nai embrionarias que se corresponden xeneticamente cos pacientes.[72]
Contaminación por reactivos usados en cultivos celulares
[editar | editar a fonte]A edición on line de Nature Medicine publicou un estudo o 4 de xaneiro de 2005 no que se afirmaba que as célualas nai embrionarias humanas dispoñibles para o financiamento federal de investigacións nos Estados Unidos están contaminadas con moléculas non humanas procedentes do medio de cultivo usado para facelas crecer.[73] Unha técnica común é usar células de rato e outras células animais para manter a pluripotencia de células nai que se dividen activamente. O problema descubriuse cando se viu que o ácido siálico non humano do medio de crecemento comprometía os usos potenciais das células nai embrionarias en humanos, segundo os científicos da Universidade de California, San Diego.[74]
Porén, un estudo publicado na edición on line de Lancet Medical Journal do 8 de marzo de 2005 detallaba información sobre unha nova liña de célula nai que se derivou de embrións humanos en condicións completamente carentes de células e de soro. Despois de máis de 6 meses de proliferación indiferenciada, estas células demostraron a potencialidade de formar derivados das tres capas xerminais embrionarias tanto in vitro coma en teratomas. Estas propiedades foron mantidas con éxito (en máis de 30 pasaxes de cultivo) nas liñas de células nai establecidas.[75]
Notas
[editar | editar a fonte]- ↑ Thomson; Itskovitz-Eldor, J; Shapiro, SS; Waknitz, MA; Swiergiel, JJ; Marshall, VS; Jones, JM (1998). "Blastocysts Embryonic Stem Cell Lines Derived from Human". Science 282 (5391). pp. 1145–1147. Bibcode:1998Sci...282.1145T. PMID 9804556. doi:10.1126/science.282.5391.1145.
- ↑ "NIH Stem Cell Basics. What are embryonic stem cells?". Arquivado dende o orixinal o 31 de agosto de 2016. Consultado o 2014-03-25.
- ↑ Baldwing A (2009). "Morality and human embryo research. Introduction to the Talking Point on morality and human embryo research.". EMBO Reports 10 (4): 299–300. PMC 2672902. PMID 19337297. doi:10.1038/embor.2009.37.
- ↑ Nakaya, Andrea C. (August 1, 2011). Biomedical ethics. San Diego, CA: ReferencePoint Press. pp. 96. ISBN 978-1601521576.
- ↑ 5,0 5,1 "Introduction: What are stem cells, and why are they important?". National Institutes of Health. Consultado o 28 October 2018.
- ↑ Carla A Herberts; Marcel SG Kwa; Harm PH Hermsen (2011). "Risk factors in the development of stem cell therapy". Journal of Translational Medicine 9 (29): 29. PMC 3070641. PMID 21418664. doi:10.1186/1479-5876-9-29.
- ↑ 7,0 7,1 Thomson, J. A.; Itskovitz-Eldor, J; Shapiro, S. S.; Waknitz, M. A.; Swiergiel, J. J.; Marshall, V. S.; Jones, J. M. (1998). "Embryonic Stem Cell Lines Derived from Human Blastocysts". Science 282 (5391): 1145–7. Bibcode:1998Sci...282.1145T. PMID 9804556. doi:10.1126/science.282.5391.1145.
- ↑ Ying; Nichols, J; Chambers, I; Smith, A (2003). "BMP Induction of Id Proteins Suppresses Differentiation and Sustains Embryonic Stem Cell Self-Renewal in Collaboration with STAT3". Cell 115 (3): 281–292. PMID 14636556. doi:10.1016/S0092-8674(03)00847-X.
- ↑ Martello, G.; Smith, A. (2014). "The nature of embryonic stem cells". Annual Review of Cell and Developmental Biology 30: 647–75. PMID 25288119. doi:10.1146/annurev-cellbio-100913-013116.
- ↑ 10,0 10,1 Boward, B.; Wu, T.; Dalton, S. (2016). "Concise Review: Control of Cell Fate Through Cell Cycle and Pluripotency Networks". Stem Cells 34 (6): 1427–36. PMC 5201256. PMID 26889666. doi:10.1002/stem.2345.
- ↑ White, J.; Stead, E.; Faast, R.; Conn, S.; Cartwright, P.; Dalton, S. (2005). "Developmental activation of the Rb-E2F pathway and establishment of cell cycle-regulated cyclin-dependent kinase activity during embryonic stem cell differentiation". Molecular Biology of the Cell 16 (4): 2018–27. PMC 1073679. PMID 15703208. doi:10.1091/mbc.e04-12-1056.
- ↑ Singh, Amar M.; Dalton, Stephen (2009-08-07). "The cell cycle and Myc intersect with mechanisms that regulate pluripotency and reprogramming". Cell Stem Cell 5 (2): 141–149. ISSN 1875-9777. PMC 2909475. PMID 19664987. doi:10.1016/j.stem.2009.07.003.
- ↑ Ter Huurne, Menno; Chappell, James; Dalton, Stephen; Stunnenberg, Hendrik G. (5 October 2017). "Distinct Cell-Cycle Control in Two Different States of Mouse Pluripotency". Cell Stem Cell 21 (4): 449–455.e4. ISSN 1875-9777. PMC 5658514. PMID 28985526. doi:10.1016/j.stem.2017.09.004.
- ↑ Ying, Qi-Long; Wray, Jason; Nichols, Jennifer; Batlle-Morera, Laura; Doble, Bradley; Woodgett, James; Cohen, Philip; Smith, Austin (2008-05-22). "The ground state of embryonic stem cell self-renewal". Nature 453 (7194): 519–523. Bibcode:2008Natur.453..519Y. ISSN 1476-4687. PMC 5328678. PMID 18497825. doi:10.1038/nature06968.
- ↑ Lee, J.; Go, Y.; Kang, I.; Han, Y. M.; Kim, J. (2010). "Oct-4 controls cell-cycle progression of embryonic stem cells". The Biochemical Journal 426 (2): 171–81. PMC 2825734. PMID 19968627. doi:10.1042/BJ20091439.
- ↑ Zhang, X.; Neganova, I.; Przyborski, S.; Yang, C.; Cooke, M.; Atkinson, S. P.; Anyfantis, G.; Fenyk, S.; Keith, W. N.; Hoare, S. F.; Hughes, O.; Strachan, T.; Stojkovic, M.; Hinds, P. W.; Armstrong, L.; Lako, M. (2009). "A role for NANOG in G1 to S transition in human embryonic stem cells through direct binding of CDK6 and CDC25A". The Journal of Cell Biology 184 (1): 67–82. PMC 2615089. PMID 19139263. doi:10.1083/jcb.200801009.
- ↑ Mahla, Ranjeet (July 19, 2016). "Stem Cell Applications in Regenerative Medicine and Disease Therapeutics". International Journal of Cell Biology 2016: 6940283. PMC 4969512. PMID 27516776. doi:10.1155/2016/6940283.
- ↑ Levenberg, S. (2002). "Endothelial cells derived from human embryonic stem cells". Proceedings of the National Academy of Sciences 99 (7): 4391–4396. Bibcode:2002PNAS...99.4391L. PMC 123658. PMID 11917100. doi:10.1073/pnas.032074999.
- ↑ 19,0 19,1 Davila, JC; Cezar, GG; Thiede, M; Strom, S; Miki, T; Trosko, J (2004). "Use and application of stem cells in toxicology". Toxicological Sciences 79 (2): 214–23. PMID 15014205. doi:10.1093/toxsci/kfh100.
- ↑ Siu, CW; Moore, JC; Li, RA (2007). "Human embryonic stem cell-derived cardiomyocytes for heart therapies". Cardiovascular & Hematological Disorders Drug Targets 7 (2): 145–52. PMID 17584049. doi:10.2174/187152907780830851.
- ↑ Perrier, A. L. (2004). "Derivation of midbrain dopamine neurons from human embryonic stem cells". Proceedings of the National Academy of Sciences 101 (34): 12543–12548. Bibcode:2004PNAS..10112543P. PMC 515094. PMID 15310843. doi:10.1073/pnas.0404700101.
- ↑ Parish, CL; Arenas, E (2007). "Stem-cell-based strategies for the treatment of Parkinson's disease". Neuro-Degenerative Diseases 4 (4): 339–47. PMID 17627139. doi:10.1159/000101892.
- ↑ Waese, EY; Kandel, RA; Stanford, WL (2008). "Application of stem cells in bone repair". Skeletal Radiology 37 (7): 601–8. PMID 18193216. doi:10.1007/s00256-007-0438-8.
- ↑ d'Amour, KA; Bang, AG; Eliazer, S; Kelly, OG; Agulnick, AD; Smart, NG; Moorman, MA; Kroon, E; Carpenter, MK; Baetge, EE (2006). "Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells". Nature Biotechnology 24 (11): 1392–401. PMID 17053790. doi:10.1038/nbt1259.
- ↑ Colen, B.D. (9 October 2014) Giant leap against diabetes The Harvard Gazette, Retrieved 24 November 2014
- ↑ Menasché, Phillip; Vanneaux, Valérie; Fabreguettes, Jean-Roch; Bel, Alain; Tosca, Lucie; Garcia, Sylvie (21 March 2015). "Towards a clinical use of human embryonic stem cell derived-cardiac progenitors: a translational experience". European Heart Journal 36 (12): 743–750. PMID 24835485. doi:10.1093/eurheartj/ehu192.
- ↑ Jensen, J; Hyllner, J; Björquist, P (2009). "Human embryonic stem cell technologies and drug discovery". Journal of Cellular Physiology 219 (3): 513–9. PMID 19277978. doi:10.1002/jcp.21732.
- ↑ Söderdahl, T; Küppers-Munther, B; Heins, N; Edsbagge, J; Björquist, P; Cotgreave, I; Jernström, B (2007). "Glutathione transferases in hepatocyte-like cells derived from human embryonic stem cells". Toxicology in Vitro 21 (5): 929–37. PMID 17346923. doi:10.1016/j.tiv.2007.01.021.
- ↑ "Dr. Yury Verlinsky, 1943–2009: Expert in reproductive technology" Arquivado 08 de agosto de 2009 en Wayback Machine. Chicago Tribune, July 20, 2009
- ↑ Mao Z, Bozzella M, Seluanov A, Gorbunova V (September 2008). "DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells". Cell Cycle 7 (18): 2902–6. PMC 2754209. PMID 18769152. doi:10.4161/cc.7.18.6679.
- ↑ 31,0 31,1 Tichy ED, Pillai R, Deng L, et al. (November 2010). "Mouse embryonic stem cells, but not somatic cells, predominantly use homologous recombination to repair double-strand DNA breaks". Stem Cells Dev. 19 (11): 1699–711. PMC 3128311. PMID 20446816. doi:10.1089/scd.2010.0058.
- ↑ Hong Y, Stambrook PJ (October 2004). "Restoration of an absent G1 arrest and protection from apoptosis in embryonic stem cells after ionizing radiation". Proc. Natl. Acad. Sci. U.S.A. 101 (40): 14443–8. Bibcode:2004PNAS..10114443H. PMC 521944. PMID 15452351. doi:10.1073/pnas.0401346101.
- ↑ Aladjem MI, Spike BT, Rodewald LW, et al. (January 1998). "ES cells do not activate p53-dependent stress responses and undergo p53-independent apoptosis in response to DNA damage". Curr. Biol. 8 (3): 145–55. PMID 9443911. doi:10.1016/S0960-9822(98)70061-2.
- ↑ Bernstein C, Bernstein H, Payne CM, Garewal H (June 2002). "DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis". Mutat. Res. 511 (2): 145–78. PMID 12052432. doi:10.1016/S1383-5742(02)00009-1.
- ↑ Cervantes RB, Stringer JR, Shao C, Tischfield JA, Stambrook PJ (March 2002). "Embryonic stem cells and somatic cells differ in mutation frequency and type". Proc. Natl. Acad. Sci. U.S.A. 99 (6): 3586–90. Bibcode:2002PNAS...99.3586C. PMC 122567. PMID 11891338. doi:10.1073/pnas.062527199.
- ↑ "FDA approves human embryonic stem cell study - CNN.com". January 23, 2009. Consultado o May 1, 2010.
- ↑ Keirstead HS, Nistor G, Bernal G, et al. (2005). "Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury" (PDF). J. Neurosci. 25 (19): 4694–705. PMC 6724772. PMID 15888645. doi:10.1523/JNEUROSCI.0311-05.2005.
- ↑ Reinberg, Steven (2009-01-23) FDA OKs 1st Embryonic Stem Cell Trial. The Washington Post
- ↑ Geron comments on FDA hold on spinal cord injury trial. geron.com (August 27, 2009)
- ↑ Vergano, Dan (11 October 2010). "Embryonic stem cells used on patient for first time". USA Today. Consultado o 12 October 2010.
- ↑ Brown, Eryn (November 15, 2011). "Geron exits stem cell research". LA Times. Consultado o 2011-11-15.
- ↑ "Great news: BioTime Subsidiary Asterias Acquires Geron Embryonic Stem Cell Program". iPScell.com. October 1, 2013.
- ↑ 43,0 43,1 43,2 43,3 California Institute of Regenerative Medicine Arquivado 24 de outubro de 2017 en Wayback Machine.. BioTime, Inc.
- ↑ Knoepfler, Paul S. (2009). "Deconstructing Stem Cell Tumorigenicity: A Roadmap to Safe Regenerative Medicine". Stem Cells 27 (5): 1050–6. PMC 2733374. PMID 19415771. doi:10.1002/stem.37.
- ↑ Varlakhanova, Natalia V.; Cotterman, Rebecca F.; Devries, Wilhelmine N.; Morgan, Judy; Donahue, Leah Rae; Murray, Stephen; Knowles, Barbara B.; Knoepfler, Paul S. (2010). "Myc maintains embryonic stem cell pluripotency and self-renewal". Differentiation 80 (1): 9–19. PMC 2916696. PMID 20537458. doi:10.1016/j.diff.2010.05.001.
- ↑ Wernig, Marius; Meissner, Alexander; Cassady, John P; Jaenisch, Rudolf (2008). "C-Myc is Dispensable for Direct Reprogramming of Mouse Fibroblasts". Cell Stem Cell 2 (1): 10–2. PMID 18371415. doi:10.1016/j.stem.2007.12.001.
- ↑ King, Nancy; Perrin, Jacob (July 7, 2014). "Ethical issues in stem cell research and therapy". Stem Cell Research & Therapy 5 (4): 85. PMC 4097842. PMID 25157428. doi:10.1186/scrt474.
- ↑ Kleinsmith LJ, Pierce GB Jr (1964). "Multipotentiality of Single Embryoncal Carcinoma Cells". Cancer Res 24: 1544–51. PMID 14234000.
- ↑ Martin GR (1980). "Teratocarcinomas and mammalian embryogenesis". Science 209 (4458): 768–76. Bibcode:1980Sci...209..768M. PMID 6250214. doi:10.1126/science.6250214.
- ↑ 50,0 50,1 Evans M, Kaufman M (1981). "Establishment in culture of pluripotent cells from mouse embryos". Nature 292 (5819): 154–6. Bibcode:1981Natur.292..154E. PMID 7242681. doi:10.1038/292154a0.
- ↑ 51,0 51,1 Martin G (1981). "Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells". Proc Natl Acad Sci USA 78 (12): 7634–8. Bibcode:1981PNAS...78.7634M. PMC 349323. PMID 6950406. doi:10.1073/pnas.78.12.7634.
- ↑ "The 2007 Nobel Prize in Physiology or Medicine - Advanced Information". Nobel Prize. Nobel Media.
- ↑ Thompson, James A.; Itskovitz-Eldor, Joseph; Shapiro, Sander S.; Waknitz, Michelle A.; Swiergiel, Jennifer J.; Marshall, Vivienne S.; Jones, Jeffrey M. (6 November 1998). "Embryonic Stem Cell Lines Derived From Human Blastocyst". Science 282 (5391): 1145–1147. Bibcode:1998Sci...282.1145T. PMID 9804556. doi:10.1126/science.282.5391.1145.
- ↑ "President George W. Bush's address on stem cell research". CNN Inside Politics. CNN. Aug 9, 2001.
- ↑ Yamanaka, Shinya; Takahashi, Kazutoshi (25 Aug 2006). "Induction of Pluripotent Stem Cells From Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors". Cell 126 (4): 663–676. PMID 16904174. doi:10.1016/j.cell.2006.07.024. hdl:2433/159777.
- ↑ Wadman, Meredith (27 January 2009). "Stem cells ready for primetime". Nature 457 (7229): 516. PMID 19177087. doi:10.1038/457516a.
- ↑ "Executive Order 13505—Removing Barriers To Responsible Scientific Research Involving Human Stem Cells" (PDF). Federal Register: Presidential Documents 74 (46). 11 March 2009.
- ↑ Mountford, JC (2008). "Human embryonic stem cells: origins, characteristics and potential for regenerative therapy". Transfus Med 18 (1): 1–12. PMID 18279188. doi:10.1111/j.1365-3148.2007.00807.x.
- ↑ Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM (1998). "Embryonic stem cell lines derived from human blastocysts". Science 282 (5391): 1145–1147. Bibcode:1998Sci...282.1145T. PMID 9804556. doi:10.1126/science.282.5391.1145.
- ↑ Smith AG, Heath JK, Donaldson DD, Wong GG, Moreau J, Stahl M, Rogers D (1988). "Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides". Nature 336 (6200): 688–690. Bibcode:1988Natur.336..688S. PMID 3143917. doi:10.1038/336688a0.
- ↑ Williams RL, Hilton DJ, Pease S, Willson TA, Stewart CL, Gearing DP, Wagner EF, Metcalf D, Nicola NA, Gough NM (1988). "Myeloid leukaemia inhibitory factor maintains the developmental potential of embryonic stem cells". Nature 336 (6200): 684–687. Bibcode:1988Natur.336..684W. PMID 3143916. doi:10.1038/336684a0.
- ↑ Ledermann B, Bürki K (1991). "Establishment of a germ-line competent C57BL/6 embryonic stem cell line". Exp Cell Res 197 (2): 254–258. PMID 1959560. doi:10.1016/0014-4827(91)90430-3.
- ↑ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (2007). "Induction of pluripotent stem cells from adult human fibroblasts by defined factors". Cell 131 (5): 861–872. PMID 18035408. doi:10.1016/j.cell.2007.11.019. hdl:2433/49782.
- ↑ Klimanskaya I, Chung Y, Becker S, Lu SJ, Lanza R (2006). "Human embryonic stem cell lines derived from single blastomeres". Nature 444 (7118): 481–5. Bibcode:2006Natur.444..481K. PMID 16929302. doi:10.1038/nature05142.
- ↑ US scientists relieved as Obama lifts ban on stem cell research, The Guardian, 10 March 2009
- ↑ Takahashi, K; Yamanaka, S (2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell 126 (4): 663–76. PMID 16904174. doi:10.1016/j.cell.2006.07.024. hdl:2433/159777.
- ↑ "The Nobel Prize in Physiology or Medicine – 2012 Press Release". Nobel Media AB. 8 October 2012.
- ↑ Wernig, Marius; Meissner, Alexander; Foreman, Ruth; Brambrink, Tobias; Ku, Manching; Hochedlinger, Konrad; Bernstein, Bradley E.; Jaenisch, Rudolf (2007-07-19). "In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state". Nature 448 (7151): 318–324. Bibcode:2007Natur.448..318W. ISSN 1476-4687. PMID 17554336. doi:10.1038/nature05944.
- ↑ "Embryonic stem cells made without embryos". Reuters. 2007-11-21.
- ↑ Weiss, Rick (2007-12-07). "Scientists Cure Mice Of Sickle Cell Using Stem Cell Technique: New Approach Is From Skin, Not Embryos". The Washington Post. pp. A02.
- ↑ Hanna, J.; Wernig, M.; Markoulaki, S.; Sun, C.-W.; Meissner, A.; Cassady, J. P.; Beard, C.; Brambrink, T.; Wu, L.-C.; Townes, T. M.; Jaenisch, R. (2007). "Treatment of Sickle Cell Anemia Mouse Model with iPS Cells Generated from Autologous Skin". Science 318 (5858): 1920–3. Bibcode:2007Sci...318.1920H. PMID 18063756. doi:10.1126/science.1152092.
- ↑ Helen Briggs (2008-01-17). "US team makes embryo clone of men". BBC. pp. A01.
- ↑ Ebert, Jessica (24 January 2005). "Human stem cells trigger immune attack". Nature News (London: Nature Publishing Group). doi:10.1038/news050124-1. Arquivado dende o orixinal o 24 de setembro de 2010. Consultado o 2009-02-27.
- ↑ Martin MJ, Muotri A, Gage F, Varki A (2005). "Human embryonic stem cells express an immunogenic nonhuman sialic acid". Nat. Med. 11 (2): 228–32. PMID 15685172. doi:10.1038/nm1181.
- ↑ Klimanskaya I, Chung Y, Meisner L, Johnson J, West MD, Lanza R (2005). "Human embryonic stem cells derived without feeder cells". Lancet 365 (9471): 1636–41. PMID 15885296. doi:10.1016/S0140-6736(05)66473-2.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Célula nai embrionaria |
Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Understanding Stem Cells: A View of the Science and Issues from the National AcademiesArquivado 09 de abril de 2010 en Wayback Machine.
- National Institutes of Health
- Obradoiro práctico da Universidade de Oxford sobre a tecnoloxía das células nai pluripotentes
- Folla de datos sobre células nai embrionarias
- Folla de datos sobre aspectos éticos na investigación sobre células nai embrionarias
- Información e alternativas á investigación sobre células nai embrionarias