ARN ribosomal 16S
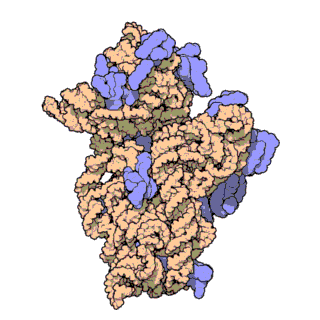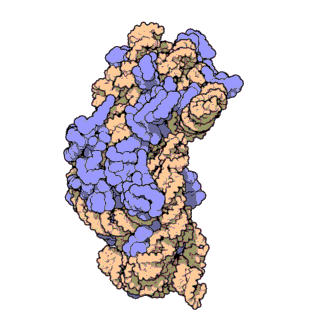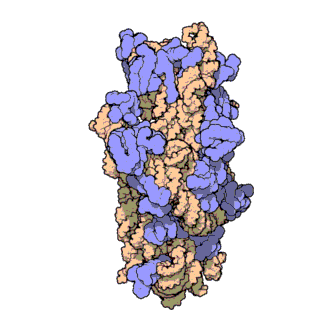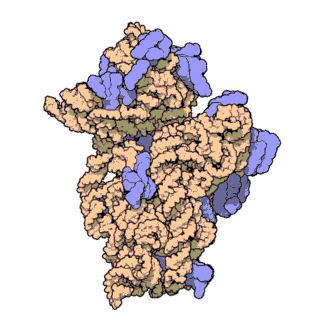
El ARN ribosomal 16S (ARNr 16S o 16S rRNA) es el componente de la subunidad menor (30S) de los ribosomas procariotas que se une a la secuencia de Shine-Dalgarno. Los genes que lo codifican son conocidos como genes del ARNr 16S, y se utilizan para la reconstrucción de filogenias debido a sus bajas tasas de evolución.[2] Carl Woese y George E. Fox fueron dos de los pioneros que se basaron en las variaciones del 16S rRNA para establecer filogenias.[3]
Pueden existir múltiples secuencias del gen 16S rRNA en una misma bacteria.[4]
Funciones
[editar]Tiene diversas funciones:
- Del mismo modo que el ARN ribosomal 23S, de gran tamaño, tiene una función estructural, sirviendo como un soporte para definir la posición de las proteínas ribosomales.
- El extremo 3' contiene la secuencia anti-Shine-Dalgarno, que se une aguas arriba con el codón de inicio AUG en el ARNm. El extremo 3' del 16S RNA se une a las proteínas S1 y S21, de las que se sabe que están implicadas en el inicio de la síntesis proteica.
- Interacciona con el 23S rRNA, favoreciendo la unión de las subunidades 50S y 30S.
- Estabiliza el correcto apareamiento codón-anticodón en el sitio A, a través de la formación de un puente de hidrógeno entre el átomo N1 de los residuos 1492 y 1493 de Adenina y el grup 2'OH de la cadena del mRNA.
Estructura
[editar]
Primers (iniciadores) universales
[editar]El gen 16S rRNA se utiliza para estudios filogenéticos[5] ya que su secuencia está altamente conservada entre las distintas especies de bacterias y arqueas.[6] Carl Woese fue pionero en esta aplicación del 16S rRNA.[2] Algunas arqueas (hiper)termófilas (esto es, del orden Thermoproteales) contienen intrones en el gen 16S rRNA que se localizan en regiones altamente conservadas y que pueden influir en la hibridación con partidores "universales".[7] Los ARN mitocondrial y cloroplástico también pueden ser amplificados con estos partidores.
El par de partidores más común fue ideado por Weisburg et al.[5] y actualmente se los conoce como 27F y 1492R; sin embargo, en algunas aplicaciones pueden ser necesarios amplicones cortos como por ejemplo la secuenciación 454 con Titanium chemistry (las lecturas de unas 500 bases son ideales), en la que el par de partidores 27F-534R cubre de V1 a V3.[8] A menudo el partidor 8F se utiliza antes que el 27F. Los dos partidores son prácticamente idénticos, aunque el 27F tiene una M en lugar de una C. La secuencia de 27F es AGAGTTTGATCMTGGCTCAG comparada con 8F.[9]
| Nombre del partidor | Secuencia (5' 3') | Referencia |
|---|---|---|
| 8F | AGA GTT TGA TCC TGG CTC AG | [10][11] |
| U1492R | GGT TAC CTT GTT ACG ACT T | Las mismas que la fila anterior |
| 928F | TAA AAC TYA AAK GAA TTG ACG GG | [12] |
| 336R | ACT GCT GCS YCC CGT AGG AGT CT | La misma que la fila anterior |
| 1100F | YAA CGA GCG CAA CCC | |
| 1100R | GGG TTG CGC TCG TTG | |
| 337F | GAC TCC TAC GGG AGG CWG CAG | |
| 907R | CCG TCA ATT CCT TTR AGT TT | |
| 785F | GGA TTA GAT ACC CTG GTA | |
| 805R | GAC TAC CAG GGT ATC TAA TC | |
| 533F | GTG CCA GCM GCC GCG GTA A | |
| 518R | GTA TTA CCG CGG CTG CTG G | |
| 27F | AGA GTT TGA TCM TGG CTC AG | [13] |
| 1492R | CGG TTA CCT TGT TAC GAC TT | La misma que la fila anterior |
Aplicaciones en PCR
[editar]Además de contar con sitios de unión para partidores altamente conservados, la secuencia del gen 16S rRNA contiene regiones hipervariables que pueden proporcionar secuencias específicas muy útiles para la identificación de bacterias.[14][15] Así pues, la secuenciación de genes 16S rRNA se ha vuelto prevalente en la microbiología médica, gracias al hecho de ser una alternativa rápida y económica a los métodos de identificación de bacterias por fenotipos.[16] Aunque originalmente se utilizaba para identificar bacterias, la secuenciación 16S acabó propiciando una reclasificación de las bacterias en nuevas especies[17] e incluso nuevos géneros.[5][18] La secuenciación 16S también se ha utilizado para describir nuevas especies que nunca han podido ser cultivadas.[19][20]
Procariontes
[editar]Es uno de los genes que codifican el ARN que constituyen con las proteínas de los ribosomas procariontes (bacterias y arqueas).
Es un gen presente a todos los procariontes. Los cebadores de la reacción en cadena de la polimerasa (PCR) utilizados para amplificar la secuencia son igualmente comunes. Esto hace que se puedan hacer los estudios de filogenia entre varias especies y troncos después de la secuenciación y comparación de sus secuencias.
Eucariontes
[editar]En los eucariontes se encuentra el gen mitocondrial 16S2 y todavía en otra forma en los cloroplastos de las plantas. Según la teoría endosimbiótica, estos dos orgánulos habrían surgido en su origen de los procariontes.
Referencias
[editar]- ↑ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution.
- ↑ a b Woese CR; Fox GE (noviembre de 1977). «Phylogenetic structure of the prokaryotic domain: the primary kingdoms». Proceedings of the National Academy of Sciences of the United States of America 74 (11): 5088-90. Bibcode:1977PNAS...74.5088W. PMC 432104. PMID 270744. doi:10.1073/pnas.74.11.5088.
- ↑ Woese CR; Kandler O; Wheelis ML (junio de 1990). «Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya». Proceedings of the National Academy of Sciences of the United States of America 87 (12): 4576-9. Bibcode:1990PNAS...87.4576W. PMC 54159. PMID 2112744. doi:10.1073/pnas.87.12.4576.
- ↑ Case RJ; Boucher Y; Dahllöf I; Holmström C; Doolittle WF; Kjelleberg S (enero de 2007). «Use of 16S rRNA and rpoB genes as molecular markers for microbial ecology studies». Applied and Environmental Microbiology 73 (1): 278-88. PMC 1797146. PMID 17071787. doi:10.1128/AEM.01177-06.
- ↑ a b c Weisburg WG; Barns SM; Pelletier DA; Lane DJ (enero de 1991). «16S ribosomal DNA amplification for phylogenetic study». Journal of Bacteriology 173 (2): 697-703. PMC 207061. PMID 1987160.
- ↑ Coenye T; Vandamme P (noviembre de 2003). «Intragenomic heterogeneity between multiple 16S ribosomal RNA operons in sequenced bacterial genomes». FEMS Microbiology Letters 228 (1): 45-9. PMID 14612235. doi:10.1016/S0378-1097(03)00717-1.
- ↑ Jay ZJ; Inskeep WP (julio de 2015). «The distribution, diversity, and importance of 16S rRNA gene introns in the order Thermoproteales». Biology Direct 10 (35): 35. PMC 4496867. PMID 26156036. doi:10.1186/s13062-015-0065-6.
- ↑ http://www.hmpdacc.org/tools_protocols.php#sequencing Archivado el 30 de octubre de 2010 en Wayback Machine.
- ↑ Primers, 16S ribosomal DNA - François Lutzoni's Lab Archivado el 27 de diciembre de 2012 en Wayback Machine.
- ↑ Eden PA; Schmidt TM; Blakemore RP; Pace NR (April 1991). «Phylogenetic analysis of Aquaspirillum magnetotacticum using polymerase chain reaction-amplified 16S rRNA-specific DNA». International Journal of Systematic Bacteriology 41 (2): 324-5. PMID 1854644. doi:10.1099/00207713-41-2-324.
- ↑ «Universal Bacterial Identification by PCR and DNA Sequencing of 16S rRNA Gene. PCR for Clinical Microbiology, 2010, Part 3, 209-214». Archivado desde el original el 21 de agosto de 2019. Consultado el 22 de junio de 2017.
- ↑ Weidner S; Arnold W; Pühler A (1996). «Diversity of uncultured microorganisms associated with the seagrass Halophila stipulacea estimated by restriction fragment length polymorphism analysis of PCR-amplified 16S rRNA genes». Appl Environ Microbiol 62 (3): 766-71. PMC 167844. PMID 8975607.
- ↑ Jiang H; Dong H; Zhang G; Yu B; Chapman LR; Fields MW (June 2006). «Microbial diversity in water and sediment of Lake Chaka, an athalassohaline lake in northwestern China». Applied and Environmental Microbiology 72 (6): 3832-45. PMC 1489620. PMID 16751487. doi:10.1128/AEM.02869-05.
- ↑ Pereira F; Carneiro J; Matthiesen R; van Asch B; Pinto N; Gusmão L; Amorim A (December 2010). «Identification of species by multiplex analysis of variable-length sequences». Nucleic Acids Research 38 (22): e203. PMC 3001097. PMID 20923781. doi:10.1093/nar/gkq865.
- ↑ Kolbert CP; Persing DH (June 1999). «Ribosomal DNA sequencing as a tool for identification of bacterial pathogens». Current Opinion in Microbiology 2 (3): 299-305. PMID 10383862. doi:10.1016/S1369-5274(99)80052-6.
- ↑ Clarridge JE (October 2004). «Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases». Clinical Microbiology Reviews 17 (4): 840-62, table of contents. PMC 523561. PMID 15489351. doi:10.1128/CMR.17.4.840-862.2004.
- ↑ Lu T; Stroot PG; Oerther DB (July 2009). «Reverse transcription of 16S rRNA to monitor ribosome-synthesizing bacterial populations in the environment». Applied and Environmental Microbiology 75 (13): 4589-98. PMC 2704851. PMID 19395563. doi:10.1128/AEM.02970-08.
- ↑ Brett PJ; DeShazer D; Woods DE (January 1998). «Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species». International Journal of Systematic Bacteriology. 48 Pt 1 (1): 317-20. PMID 9542103. doi:10.1099/00207713-48-1-317.
- ↑ Schmidt TM; Relman DA (1994). «Phylogenetic identification of uncultured pathogens using ribosomal RNA sequences». Methods in Enzymology. Methods in Enzymology 235: 205–22. ISBN 978-0-12-182136-4. PMID 7520119. doi:10.1016/0076-6879(94)35142-2.
- ↑ Gray JP; Herwig RP (November 1996). «Phylogenetic analysis of the bacterial communities in marine sediments». Applied and Environmental Microbiology 62 (11): 4049-59. PMC 168226. PMID 8899989.
Enlaces externos
[editar]- University of Washington Laboratory Medicine: Molecular Diagnosis | Bacterial Sequencing
- The Ribosomal Database Project Archivado el 19 de agosto de 2020 en Wayback Machine.
- «Ribosomal RNA». [Consulta: 27 de octubre de 2012].
- MIMt - Base de datos 16S para clasificacion de microorganismos.