„Berylliumsulfat“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Vorlagen Parameterwartung mit AWB |
Rjh (Diskussion | Beiträge) K +GHS |
||
| Zeile 10: | Zeile 10: | ||
| Molare Masse = 105,08 g·[[mol]]<sup>−1</sup> (wasserfrei)<br /> 177,14 g·[[mol]]<sup>−1</sup> (Tetrahydrat) |
| Molare Masse = 105,08 g·[[mol]]<sup>−1</sup> (wasserfrei)<br /> 177,14 g·[[mol]]<sup>−1</sup> (Tetrahydrat) |
||
| Aggregat = fest |
| Aggregat = fest |
||
| Dichte = 1,71 g·cm<sup>−3</sup> (Tetrahydrat)<ref>{{Sigma-Aldrich|SIAL|14270|Datum=11. März 2010}}</ref> |
| Dichte = 1,71 g·cm<sup>−3</sup> (Tetrahydrat)<ref name="Sigma">{{Sigma-Aldrich|SIAL|14270|Datum=11. März 2010}}</ref> |
||
| Schmelzpunkt = 580 [[Grad Celsius|°C]] (Zersetzung)<ref name="Wiberg">Holleman-Wiberg: ''Lehrbuch der Anorganischen Chemie'', Walter de Gruyter;Berlin, New York 1985; 91.–100. Auflage; S. 903</ref> |
| Schmelzpunkt = 580 [[Grad Celsius|°C]] (Zersetzung)<ref name="Wiberg">Holleman-Wiberg: ''Lehrbuch der Anorganischen Chemie'', Walter de Gruyter;Berlin, New York 1985; 91.–100. Auflage; S. 903</ref> |
||
| Siedepunkt = |
| Siedepunkt = |
||
| Dampfdruck = |
| Dampfdruck = |
||
| Löslichkeit = sehr gut löslich in Wasser, unlöslich in [[Ethanol]]<ref name="merck index">{{Literatur | Autor= Susan Budavari (Hrsg.) | Titel= [[Merck Index|The Merck Index]] | Auflage=12 | Verlag= Merck & Co. | Ort= Whitehouse Station, New Jersey, USA | Jahr= 1996 | ISBN=0911910-12-3}}</ref> |
| Löslichkeit = sehr gut löslich in Wasser, unlöslich in [[Ethanol]]<ref name="merck index">{{Literatur | Autor= Susan Budavari (Hrsg.) | Titel= [[Merck Index|The Merck Index]] | Auflage=12 | Verlag= Merck & Co. | Ort= Whitehouse Station, New Jersey, USA | Jahr= 1996 | ISBN=0911910-12-3}}</ref> |
||
| Quelle GHS-Kz = <ref name="GESTIS">{{GESTIS|ZVG= |CAS=13510-49-1|Datum=13. März 2011}}.</ref> |
|||
| GHS-Piktogramme = {{GHS-Piktogramme|06|08|09}} |
|||
| GHS-Signalwort = Gefahr |
|||
| H = {{H-Sätze|350i|330|301|372|319|335|315|317|411}} |
|||
| EUH = {{EUH-Sätze|-}} |
|||
| P = {{P-Sätze|201|260|273|280|284|301+310}} |
|||
| Quelle P = <ref name="Sigma" /> |
|||
| Quelle GefStKz = {{RL|Sammelbegriff=Berylliumverbindungen|ZVG=82790|Datum=31. März 2009}} |
| Quelle GefStKz = {{RL|Sammelbegriff=Berylliumverbindungen|ZVG=82790|Datum=31. März 2009}} |
||
| Gefahrensymbole = {{Gefahrensymbole|T+|N}} |
| Gefahrensymbole = {{Gefahrensymbole|T+|N}} |
||
| Zeile 62: | Zeile 69: | ||
Äußerst selten wird Berylliumsulfat auch in der [[Homöopathie]] eingesetzt. |
Äußerst selten wird Berylliumsulfat auch in der [[Homöopathie]] eingesetzt. |
||
== |
== Einzelnachweise == |
||
<references /> |
<references /> |
||
Version vom 13. März 2011, 07:56 Uhr
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
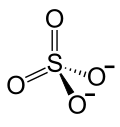
| |||||||||
| Allgemeines | |||||||||
| Name | Berylliumsulfat | ||||||||
| Summenformel | BeSO4 (wasserfrei)
| ||||||||
| Kurzbeschreibung |
weißes geruchloser Feststoff[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 105,08 g·mol−1 (wasserfrei) 177,14 g·mol−1 (Tetrahydrat) | ||||||||
| Aggregatzustand |
fest | ||||||||
| Dichte |
1,71 g·cm−3 (Tetrahydrat)[2] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||
Berylliumsulfat ist ein weißes Beryllium-Salz der Schwefelsäure mit der Summenformel BeSO4. Es wurde erstmals 1815 von Berzelius isoliert[6].
Herstellung
Berylliumsulfat kann durch Auflösung von Berylliumcarbonat oder Berylliumhydroxid in verdünnter Schwefelsäure gewonnen werden.[7]
Eigenschaften
Physikalische Eigenschaften
Vom Berylliumsulfat existieren mehrere Hydrate: Im Handel erhält man die Verbindung als Tetrahydrat mit der Summenformel BeSO4 · 4 H2O, welches bei 111,5 °C in das Dihydrat BeSO4 · 2 H2O, und bei 158 °C in das Monohydrat BeSO4 · H2O übergeht.[7] Dieses kann dann bei ca. 400°C zu wasserfreiem Berylliumsulfat entwässert werden. Das wasserfreie Sulfat selbst ist bis ca. 580°C stabil [8]. Ferner existiert ein Hexahydrat BeSO4 · 6 H2O, das bei ca. 76 °C in das Dihydrat übergeht.[7] Wasserfreies Berylliumsulfat ist nur langsam und schlecht wasserlöslich. Dagegen ist das Tetrahydrat gut wasserlöslich.
Chemische Eigenschaften
Im Salz liegt das Berylliumion als [Be(H2O)4]2+ vor, da die Koordinationszahl 4 für Berylliumionen typisch sind (Hauptgruppenelement) [9]. Es bildet mit Alkalimetallsulfaten schlecht kristallisierende blumenkohlartige Krusten die als Doppelsalze mit der Summenformel Me2Be(SO4)2 · 2 H2O aufgefasst werden, z.B.: K2Be(SO4)2 · 2 H2O.[8]
Biologische Bedeutung

Berylliumsulfat ist äußerst giftig. Bei Ratten konnte auch eine stark karzinogene Wirkung beobachtet werden. [10] Beim Menschen hingegen sind nur wenige Fälle bekannt.
Vergiftung
Es sind verschiedene Formen von Berylliumvergiftungen bekannt, die zumeist von den Stäuben der Substanzen ausgehen: [11]
Toxische Pneumonie:
- nach wiederholter oder seltener einmaliger Inhalation mit wechselnder Latenzzeit von wenigen Tagen bis mehreren Jahren ohne erkennbaren Anlass
- Symptome sind Atemnot, Husten und Fieber
- Die Krankheit verläuft schleppend und Tod kann nach Monaten des Siechtums eintreten
Berylliose:
- eine sich langsam entwickelnde granulomatöse Reaktion des Lungengewebes ("Sandsturmlunge")
Verwendung
Eine Mischung aus Berylliumsulfat und Radiumsulfat diente bei der Entdeckung der Kernspaltung als Neutronenquelle. Äußerst selten wird Berylliumsulfat auch in der Homöopathie eingesetzt.
Einzelnachweise
- ↑ Datenblatt Berylliumsulfat bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b Datenblatt Berylliumsulfat bei Sigma-Aldrich (PDF).
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter;Berlin, New York 1985; 91.–100. Auflage; S. 903
- ↑ Susan Budavari (Hrsg.): The Merck Index. 12. Auflage. Merck & Co., Whitehouse Station, New Jersey, USA 1996, ISBN 0-911910-12-3.
- ↑ Eintrag zu CAS-Nr. 13510-49-1 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Ch. L. Parsons - The Chemistry and Literature of Beryllium S. 33 ff. (1909, London)
- ↑ a b c M. Levi-Malvano: "Die Hydrate des Berylliumsulfats" in Zeitschr. f. anorg. Chem. 1906, 48, S. 446ff. Volltext
- ↑ a b Gmelins Handbuch der Anorganischen Chemie, BERYLLIUM, System Nummer 26, Achte Auflage, Verlag Chemie GmbH Berlin 1930
- ↑ M. Binnewies - Allgemeine und Anorganische Chemie, 1. Auflage, S. 355 f., 2004 (ISBN: 3-8274-0208-5)
- ↑ umwelt-online.de
- ↑ W. Forth - Allgemeine und spezielle Toxikologie und Pharmakologie 6. Auflage S. 781, 1992 (ISBN: 3-411-15026-2)


